
Rastvori (otopine)
UNIVERZITET U TRAVNIKU
FARMACEUTSKO ZDRAVSTVENI FAKULTET
ODSJEK/SMIJER: Farmacija
Predmet
: Fizikalna hemija
Tema
:
Rastvori i faktori koji utječu na rastvorljivost
Seminarski rad
Kolegij
: Fizikalna hemija
Student
: Azra Šoljanin
Mentor
: Prof.dr. Emir Turkušić
Broj indexa
: 1003/14
Travnik, oktobar, 2015.
Sadržaj:
1. Uvod ………………………………………………………………………….. 3
2. Općenito o otopinama………………………………………………………… 4
2.1.
Otapala …………………………………………………………..…… 4
2.2.
Topljivost otopina …………………………………………………..…7
2.3.
Povećanje površine čvrstih supstancija ………………………….........7
2.4.
Dadatak solubilizatora ………………………………………...…...….8
3. Procesi otapanja………………………………………………………………..9
4. Toplina otapanja ……………………………………………………………..10
5. Učinak temperature I tlaka na topljivost …………………………………….13
6. Temperature vrelišta I tališta otopina ………………………………………..15
6.1.
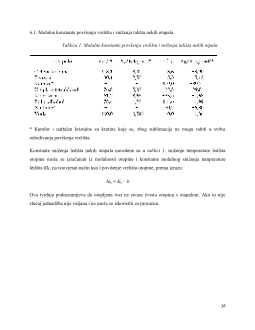
Molalne konstante povišenja vrelišta I sniženja tališta ….-………….16
7. Otopine elektrolita …………………………………………………………...17
8. Izrada otopina ………………………………………………………………..19
9. Zaključak …………………………………………………………………….20
10. Literatura …………………………………………………………………….21
11. Popis slika ………………………………………………………………...…22
2

2. Općenito o otopinama
Otapala su najčešće voda, etanol, glicerol, te vegetabilna ili mineralna ulja.
Uobičajeni primjeri su kuhinjska sol ili šećer koji su krutine otopljeni u vodi koja je tekućina. U
tekućinama se također mogu otapati i plinovi, npr. ugljikov dioksid i kisik u vodi, dok se između
sebe plinovi otapaju bez ograničenja. Primjeri krutih otopina su mnoge slitine i minerali.
Sposobnost otapanja tvari u nekom otapalu naziva se
topljivost.
2.1. Otapala
Radi toksiciteta, hlapljivosti, zapaljivosti i stabilnosti otopina, za farmaceutsku upotrebu, izbor
otapala jako je sužen.
Otopine je moguće izrađivati pomoću vode, odnosno nevodenih otapala koja se miješaju s vodom
ili uz pomoć nevodenih otapala koja se ne miješaju s vodom.
NEVODENA OTAPALA KOJA SE MIJEŠAJU S VODOM:
I.
Etanol,
II.
glicerol,
III.
propilenglikol niskih relativnih molekulskih masa.
NEVODENA OTAPALA KOJA SE NE MIJEŠAJU S VODOM:
I.
Bilnja ulja,
II.
polusintetska ulja,
III.
esteri.
4
Voda
Voda (
Slika 1
.) je najčešće otapalo pri izradi otopina. Kod većine izrada primjenjuje se
pročišćena voda (
Aqua destilata),
koju dobivamo destilacijom ili demineralizacijom pitke vode.
Treba naglasiti da su propisi za čistoću u ovom slučaju strogi, a također se ispituju i pirogene
supstancije. Stupanj čistoće je odgovarajući, dok je pH vrijednost 5-7. Ova voda se čuva u
posudama od neutralnog stakla visoke hidrolitičke otpornosti. Nakon što se boce napune, moraju
se upotrijebiti u roku od 10 dana. Za pročišćenu vodu također koristimo nazive: destilirana voda
(
Aqua destilata)
i demineralizirana voda
(Aqua demineralisata).
Slika 1 – Molekula vode
Etanol
Etanol je produkt fermentacije šećera pomoću enzima maltaze koji prevodi maltozu u glukozu, a
zimaza iz kvaščevih gljivica prevodi glukozu u alkohol (alkoholno vrenje). Etanol sintetski
možemo dobiti iz etilena, a pri miješanju vode i etanola dolazi do kontrakcije volumena. Dobro
se miješa i s mnogim organskim supstancijama poput: smole, eterična ulja i njihovi sastojci kao
što su kamfor i mentol. U Ph.Jug.IV oficinalna su dva etanola:
I.
Aethanolum concentratum 96% ; syn : Spiritus concentratus
II.
Aethanolum dilutum 70% ; syn : Spiritus (vini) dilutus
5
Polusintetska ulja
Ulje koje dolazi u promet pod zaštićenim nazivom MIglyol 812 smjesa je triglicerida zasićenih
masnih kiselina sa 8, 10 i 12 atoma ugljika.
Esteri
Etiloleat
(Atethylis oleas)
u odnosu prema biljnim uljima, ima niz prednosti. Ne skrućuje se na
nižim temperaturama, manje je viskoznosti, određenog je hemijskog sastava, brže apsorbira i
može pojačati i produljiti djelovanje ljekovitih supstancija.
Nedostatak mu je naznačena oksidabilnost, ali nju se može spriječiti dodatkom antioksidansa,
gaziranje otopina dušikom i punjenjem u smeđe posude. Ne smijemo koristiti boce sa gumenim
zatvaračima, jer ih etiloleat otapa. Postoji i izopropilmiristat
(Isopropylis myrista )
koji je za
razliku od etiloleata stabilan prema oksidacijskim i hidrolitičkim utjecajima.
2.2. Topljivost otopina
Topljivost je koncentracija otopljene, krute tvari pri određenoj temperaturi.
PREMA KOLČINI OTOPLJENE SUPSTANCIJE NA ODREĐENOJ TEMPERATURI
OTOPINE MOGU BITI:
I.
nezasićene,
II.
zasićene,
III.
prezasićene.
2.3. Povećanje površine čvrstih supstancija
Za povećanje topljivosti teško topljivih supstancija potrebno je
mikroniziranje,
jer se zbog
međupovršinske napetosti topljivost malih čestica povećava.
Supstancije s polarnim skupinama otapaju polarna otapala (voda, etanol), a supstancije
nepolarnih osobina otapaju razna organska otapala (eter, kloroform, benzen, ugljik – tetraklorid).
7
Ovaj materijal je namenjen za učenje i pripremu, ne za predaju.
Slični dokumenti



























































