
Adsorpcija fosfata iz vode na sepiolitima modifikovanim cirkonijum-oskidom Pregled
1
1. Увод
Фосфор је један од биогених елемената, кључан за цео живи свет. Због велике
реактивности у природи се никада не јавља у слободном стању, већ искључиво у склопу једињења.
Једна од значајнијих класа једињења фофора су соли фосфорне киселине или фосфати. Фосфор
у саставу фосфата кружи у природи и тиме учествује у ланцу исхране живих бића.
Фосфати се јављају у облику ортофосфата, полифосфата и органских фосфата. Велики
значај фосфата у производњи ђубрива, детерџената, и за третмане воде у котловима и
водоводима у циљу спречавања корозије довео је до повећане количине индустријски
произведених фосфата. Тиме фосфати у виду отпада из домаћинстава и индустријских процеса
или отицањем са нађубреног земљишта најчешће доспевају у водотоке. Ако се у воденом
екосистему одређене загађености нађе већа количина фосфата од оне која је потребна за
прехрану живих организама доћи ће до прекомерног размножавања алги што доводи до
обојености и замућивања воде. Тиме се блокира сунчева светлост и биљни организми изумиру.
Приликом микробиолошке разградње биљних организама троши се кисеоник. Недостатак
кисеоника у води подстиче одвијање анаеробних процеса који су праћени појавом непријатних
мириса. Претходно описана појава се назива еутрофикација.
Једно од решења за овај све заступљенији проблем у свету јесте уклањање фосфата из
воде. Истраживања су дала различите физичко-хемијске и биолошке поступке за уклањање
фосфата. Међу физичко-хемијским поступцима истиче се адсорпција фосфата на различитим
материјалима. Разноврсност природних и вештачких материјала као и нуспроизвода са високим
адсорпционим капацитетима и афинитетом према фосфатима и могућност различитих
модификација адсорбената чини поступак адсорпције фосфата корисним и отвореним за
унапређивање.
Показано је да бројни хидроксиди и оксиди метала представљају ефикасне адсорбенте за
фосфате, а највећу ефикасност имају оксихидроксиди цирконијума захваљујући великом
афинитету за грађење комплекса са фосфатима. Ефикасни адсорбенти за фосфате могу се
добити формирањем композита наночестица цирконијум(IV)-оксида са инертним материјалима
велике специфичне површине. Један од јефтиних природних минерала велике специфичне
површине који се може користити за добијање композитног адсорбента за адсорпцију фосфата је
сепиолит, природни глинени минерал влакнасте структуре.
У овом завршном раду је испитивана ефикасности уклањања фосфата из воде
коришћењем адсорбената који су добијени модификацијом сепиолита цирконијум(IV)-оксидом. Као
полазни материал коришћени су термички третирани сепиолити, на 300, односно 550
º
C, у циљу
уклањања зеолитске и везане воде. Модификација је изведена у инертним условима, применом
раствора цирконијум-изопропоксида у толуолу. За карактеризацију добијених адсорбената
коришћене су следеће методе: рендгенска дифракциона анализа (XRD), инфрацрвена
спектроскопска анализа (FTIR), скенирајућа електронска микроскопија (SEM) и енергетска
дисперзиона анализа (EDS). Адсорпциони капацитет добијених адсорбената процењен јe на
основу адсорпционих изотерми. Концентрација фосфата је одређивана методом UV-Vis
спектрофотометрије. Резултати испитивања адсорпције обрађени су применом Лангмировог и
Фројндлиховог модела.
2
Теоријски део

4
С обзиром на велику потребу фосфата као ђубрива стварају се све погоднији услови за
цветање алги што је процес прекомерног развоја алги у воденим системима због повишеног
прилива азота и фосфора. Повећане количине алги могу довести до појаве која се назива
еутрофикација. [5]
Наиме, живи организми у воденој средини неповратно троше хранљиве материје, које су
углавном присутне у ниским концентрацијама. Tо само по себи доводи до повећаног загађења. При
великим загађењима долази до изражаја штетно дејство фосфата на водене екосистеме, а
посебно језера. Према истраживањима, незагађена језера могу да апсорбују изненађујуће велике
количине фосфата без штетних последица. То је због специфичног ланца исхране у таквим
екосистемима. Тешкоће настају када је само језеро већ нечисто. Зоопланктони који се ту налазе су
осетљиви на своје окружење и многе супстанце су токсичне за њих. Ако је присутна било која од
ових супстанци, укључујући и фосфате, становништво зоопланктона се не може повећати.
Додавање фосфата у овај загађен систем утиче на повећан пораст алги. Када се намноже оне
блокирају сунчеву светлост, водени биљни организми изумиру и разграђују се при чему троше
растворени кисеоник. Мањак кисеоника подстиче одигравање анаеробних процеса, а тиме и
стварање сумпоровитих мириса. Рибе и остали водени организми изумиру због недостатка
хранљивих материја и кисеоника. За водени систем у оваквом стању се сматра да је еутрофирао.
[1,6]
Еутрофикација је постала озбиљан проблем животне средине широм света. Око 50%
језера и акумулиране воде на свим континентима осим Африке и Океаније је еутрофирало. У
језерима, концентрација фосфора изнад 0,02 ppm генерално убрзава еутрофикацију. [5]
У циљу ублаживања раста водених биљака и фитопланктонских алги, агенције за заштиту животне
средине су у обавези да утврде укупно максимално дневно оптерећење фосфором (УМДО) за
многе сливове. Поред захтева УМДО, неки прописи могу да захтевају концентрацију фосфора у
ефлуентима отпадне воде до 50 µg/L. Фосфор постоји у комуналним отпадним водама у
различитим облицима, при чему се дефинише укупни фосфор, растворљиви фосфор и честице
фосфора. У општем случају, примарни и секундарни третман је ефикасан у уклањању честица
фосфора. Фосфор је у секундарним ефлуентима углавном растворан и присутан као ортофосфат.
Осим тога, само ортофосфати се троше за раст фитопланктона што изазива еутрофикацију
површинских вода. Сходно томе, терцијарни третман секундарних комуналних отпадних вода за
уклањање ортофосфата постаје све неопходнији како би се задовољили еколошки прописи широм
света. [7]
2.3. Методе уклањања фосфата из воде
Најчешћи поступци уклањања фосфата из воде су:
- физичко-хемијске методе (преципитација, електропреципитација и магнетна сепарација)
- биолошко уклањање
-
сорпција на разним материјалима
Преципитација
Преципитација је хемијски процес уклањања фофора помоћу соли тровалентних метала
(најчешће се користе соли алуминијума и гвожђа) тако што долази до њихове реакције са
једињењима фосфора која су заступљена у води, а затим и до таложења насталих производа.
Такође, за преципитацију фосфора често се користи и креч. При додатку одговарајуће количине
негашеног креча у воду која садржи фосфор, таложи се хидроксиапатит (Ca
5
(OH)(PO
4
)
3
)
.
У зависности од места дозирања преципитација може да се користи у различитим
технолошким шемама као :
• Примарна преципитација у постројењима за механичку прераду отпадне воде
(смањује се
концентрација биоразградивих органских једињења)
• Примарна преципитација након које следи даљи биолошки третман
• Симултана преципитација (истовремена одигравање преципитације и биолошког третмана)
• Финална преципитаци
5
Електропреципитација
Третман воде на бази електричне енергије обухвата хемијску преципитацију уз помоћ
једињења гвожђа (оксида) формираних на једној од електрода. Ипак и поред разних варијација
овог процеса током година истраживања није се дошло до значајнијег напретка.
Магнетна сепарација
Магнетна сепарација је процес уклањања фосфора из течности помоћу магнетног поља.
Како сам фосфор, који се претходно мора превести у нерастворан облик, нема значајна магнетна
својства, додају се такозвани магнетни носачи, најчешће магнетит (Fe
3
O
4
). Тиме се омогућује
деловање магнетног поља на фосфор, а самим тим и одигравање процеса магнетне сепарације.
Овакав метод издвајања не захтева коришћење додатних хемикалија, а и сама сепарација честица
из течне фазе је бржа. То све чини магнетну сепарацију повољном за коришћење и интересантном
за даља истраживања.
Биолошко уклањање
Биолошки третман воде у циљу уклањања фосфата подразумева два независна
механизма: директна апсорпција фосфата у биореакторима преко суспендованих ћелија и биљака
и уклањање преко повећаног капацитета складиштења фосфора у облику полифосфата са
микробиолошком масом у активном муљу на постројењима за прераду отпадних вода. [8, 9, 10]
Сорпција фосфата
Фосфати се могу сорбовати на различитим природним и вештачким материјалима као и на
индустријским нуспроизводима. Природни материјали се могу користити без претходног третмана
или уз благи третман како би се побољшао, ако је могуће, капацитет сорпције. Да би били погодни
за сорпцију, како природни, тако и вештачки материјали морају бити порозни, имати велику
специфичну површину и афинитет према фосфатима. [12, 13, 14] Што се тиче структуре сорбента,
показало се да влакнасти материјали имају боље кинетичке перформансе при сорпцији фосфата
од зрнастих материјала. [15]
Код неких природних материјала због њиховог разноликог састава поред сорптивног
уклањања фосфата упоредо је могуће и одвијање преципитације фосфата калцијума алуминијума
и гвожђа. Материјали који су испитивани као сорбенти поред сепиолита су апатит, боксит, зеолит,
доломит, песак, шљунак, кречњак, бентонит, мермер, хумус, тресет итд.
Разлог за коришћење синтетисаних материјала и индустријских нуспроизвода поред
великог избора природних материјала лежи у већ познатој чињеници да постоје ограничене
количине одређених природних материјала на планети Земљи. Поред тога индустријски
нуспроизводи се углавном одлажу на депоније па се на овај начин рециклирају. Углавном се
узимају познати ефикасни сорбенти и прилагођавају сорпцији фосфата. Мноштво природних па и
неких вештачких материјала када се модификује једињењима Fe(III) даје већи сорптивни капацитет
за фосфате. Генерално, највећи афинитет за фосфате имају сорбенти на бази гвожђа, лантана и
цирконијума.
Од вештачки синтетисаних материјала за сорпцију фосфата се користе: активни угаљ,
разни хидроксиди метала, слојевити дупли хидроксиди, лигандски измењивачи на бази полимера,
алунит, композитни адсорбенти итд.
Активни угаљ је одличан адсорбент због велике специфичне површине и порозности.
Поред тога, ако се модификује јонима, оксидима или хидроксидима тровалентног гвожђа и лантана
може му се повећати сорпциони капацитет. Од хидроксида метала цирконијум-хидроксид је један
од значајнијих због великог афинитета за грађење комплекса са фосфатима и високе хемијске
стабилности у киселим и базним условима. Такође, код неких материјала је могуће развијање
њихове површине, што може повољно утицати на капацитет сорпције.
Материјали који се користе за сорпцију фосфата поред претходно наведених су и
активирани алуминијум оксид, пиринчане љуске, црвени муљ итд. [11, 12, 13, 15]
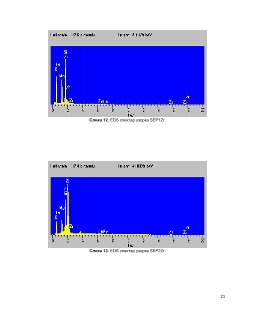
7
3.2. Структура
Сепиолит се састоји из идентичних трака који су тако постављени да праве отворене и
затворене (зеолитске) канале. (слика 1.).
Слика 1.
Структура минерала сепиолита.
Траке су сачињене од два континуална тетраедарска слоја између којих се налази један
дисконтинуални октаедарски слој, што значи да је сепиолит минерал типа 2:1. Тетраедарски слој
чине међусобно повезани SiO
4
-
тетраедри. Атоми кисеоника у врховима тетраедара су усмерени
на исту страну у односу на равни базичних кисеоничних атома. У средишњем слоју блока,
хидроксилне групе и атоми кисеоника граде октаедарске шупљине у којима је смештен магнезијум.
Два горе поменута слоја су повезани преко атома кисеоника и хидроксилних група. На крајевима
октаедарског слоја везана су по два молекула воде (OH
2
) која се још називају и координациона
вода због тога што се налазе у координационој сфери магнезијума. Код силикатног слоја нема
прекида, али на сваких шест јединица долази до инверзије правца ивичног крајњег тетраедра.
Тиме се стварају канали у којима се налази структурно слободна (зеолитска) и координационо
везана вода.
Морфолошки израз ове структуре пројектоване у простору су влакна. [22].
3.3. Термичка својства
Садржај воде у сепиолиту зависи од влажности. Ако се сепиолит загрева до 250 °C,
отприлике 60 % од укупне воде се губи. Ова вода је делом зеолитска вода, а делом је
адсорбована вода из ваздуха. Овакав процес је повратан, јер не долази до значајне промене
кристалне решетке сепиолита. Нема ни промене у порозности.
Приликом даљег загревања долази до савијања структуре сепиолита након чега процес
постаје неповратан. Савијање настаје када је уклоњена приближно половина координационе воде
која је везана за ивичне атоме магнезијума унутар канала. Промене почињу у близини 175 °C под
вакуумом и на око 300 °C у ваздуху. Након овога друга половина координационе воде улази у ново
окружење, сачињено од хексагоналних шупљина суседне површине. Жарењем на 550 °C као што
се може видети са слике 2, долази до потпуног савијања структуре и притом је ослобођена друга
половина координационо везане воде. Из овако измењене структуре преосталу воду је могуће
уклонити само на високим температурама јер је практично заробљена и самим тим јој је отежана
дифузија. Прави анхидрид настаје на око 500 °C под вакуумом тј. око 800 °C у ваздуху када је
Želiš da pročitaš svih 30 strana?
Prijavi se i preuzmi ceo dokument.
Slični dokumenti

Ovaj materijal je namenjen za učenje i pripremu, ne za predaju.


























































