Biogeni elementi Pregled
SEMINARSKI RAD
“OPŠTA I NEORGANSKA HEMIJA“
TEMA:
BIOGENI ELEMENTI
Profesor: Student:
SADRŽAJ:

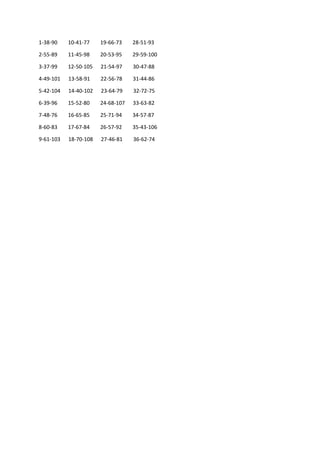
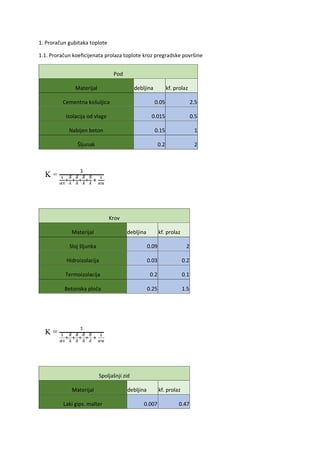
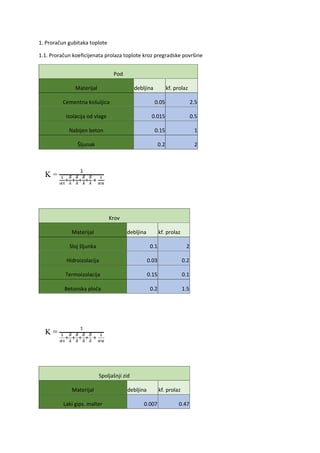
Hemijski elementi koji izgrađuju ćeliju nazivaju se biogeni elementi. Prema količini u
kojoj se nalaze u ćeliji najvažniji su makroelementi (grč. macro-mnogo), kojima pripadaju C
(ugljenik), H (vodonik), O (kiseonik), N (azot), S (sumpor) i fosfor (P). Makroelementi su
kovalentno vezani u organskim biomolekulima kao npr. aminokiselinama, ugljenim
hidratima, lipidima, nukleinskim kiselinama i dr. jedinjenjima i čine 99% biomase biljnog
organizma. Oni imaju relativno malu atomsku masu, sposobni su da grade višestruke veze i
da učestvuju u građenju strukturnih i “energetskih” jedinjenja. Čine osnovu života na Zemlji.
Vodonik
Vodonik (H, lat. Hydrogenium, naziv izveden iz latinskog “stvaralac vode”) je najlakši
hemijski element. Nalazi se u IA grupi Periodnog sistema elemenata. Javlja se u obliku dva
stabilna izotopa 1 H (protijum) i 2 H (deuterijum, koji se takođe označava simbolom D) kao i
jednog nestabilnog 3 H (tricijum, koji se označava T). Pošto je jedan od stabilnih izotopa dva
puta teži od drugog, oni se međusobno dosta razlikuju po hemijskim svojstvima.
Deuterijum poznat i kao teški vodonik, je stabilni izotop vodonika čije atomsko jezgro sadrži
po jedan proton i neutron, dok jezgro običnog vodonika ima samo jedan proton. Hemijski
simbol tricijuma je 3 H, a pojednostavljeno se može obeležiti sa T. U poređenju sa
deuterijumom, pored što ima proton u atomskom jezgru, ne posjeduje jedan, već dva
neutrona. Vodonik se javlja se u vidu dvoatomnih molekula H2.
Koncentracija vodonikovih jona izražava se pomoću pH vrednosti.
Pod normalnim uslovima vodonik je u gasovitom agregatnom stanju. Nije otrovan. Zapaljiv
je a granica eksplozivnosti u vazduhu od 4-94%. Zvanično vodonik je otkrio 1766. godine
Henri Kevendiš.
Jedinjenja
Vodonik-peroksid (H2O2) je plavičasto, u razblaženoj formi bezbojno, tečno jedinjenje
vodonika i kiseonika. Sadrži dve polarne O-H veze pa reaguje kao slaba baza. Veoma je jako
oksidaciono sredstvo. Vodonik-peroksid je nestabilno jedinjenje i raspada se na povišenoj
temperaturi ili u prisustvu katalizatora.
Voda je hemijsko jedinjenje kiseonika i vodonika.Hemijska formula vode je H2O. Voda je
supstanca bez mirisa, ukusa i boje. Temperatura mržnjenja vode je 0 °C, a temperatura
ključanja je 100 °C. Čvrsto agregatno stanje se zove led, a gasovito para. Voda je tečnost bez
mirisa i ukusa koja je prisutna skoro svuda: u okeanima, morima, rekama, jezerima, gasovita
u oblacima, zamrznuta u glečerima ili u velikim podzemnim bazenima ispod krečnjačkih
stena. Ovu podzemnu vodu koristi živi svijet koji bez nje ne može da opstane.
Ljudsko telo čini 72 % vode, pri čemu se ona stalno unosi i izbacuje. Voda je sastavljena od
dva atoma vodonika (Н) i jednog atoma kiseonika (O). Spajanjem vodonika direktno sa
elementima nastaju hidridi, koji mogu biti hidridi nemetala (halogenvodonici, H2O, H2S,
NH3, PH3, AsH3) ili hidridi metala u kojima je njegov oksidacioni broj -1.
Biološki značaj
Vodonik ulazi u sastav svih živih organizama kao jedan od osnovnih elemenata od koga su
sastavljena sva organska jedinjenja e takođe i u sastav vode bez koje nema života na Zemlji.
Upotreba
Vodonik se upotrebljavao za punjenje balona, kao lakši od vazduha, ali je zamenjen
helijumom zbog opasnosti od požara. Danas se koristi za autogeno zavarivanje.
Upotrebljava se za hidrogenizaciju biljnih ulja, dobijanje amonijaka i metanolaVodonik se
koristi u procesima sagorevanja (industrije stakla, obrada dragog kamenja, sečenja i
zavarivanja metala), u hemijskoj industriji za redukcju, hidrogenizaciju i desulfurizaciju, u
proizvodnji električne energije, instrumentalnoj analitici, meteorologiji itd.
Ugljenik
Ugljenik (C, latinski carboneum) јe nemetal, IVA grupe.Da јe hemiјski element prvi јe
utvrdio Antoine Lavoisier.
Dijamant (grč. adams- nepobediv) je bezbojna, kristalna supstanca sa velikim indeksom
prelamanja svetlosti. Struktura dijamanta odgovara sp3 hibridizaciji ugljenika. Dijamant je
alotropska modifikacija ugljenika. Na Mosovoj skali tvrdoće zauzima najviše mesto sa
tvrdoćom 10.Mera za težinu diajamanata je karat. Jedan karat = 0,2 grama.
Grafit je najčešća i najstabilnija alotropska modifikacija ugljenika. To je jedna od naјmekših
supstanci. Sive je boje.
Aktivni ugalj je posebno pripremljena vrsta ugljenika porozne kristalne strukture. Prostori
pora u aktivnom uglju ne prelaze veličinu od 10 Angstrema.
Fuleren je alotropska modifikacija ugljenika, otkrivena 1985. godine, kada je pukom igrom
slučaja laserski sintetizovan molekul C60. Za ovo otkriće naučnici Harold Kroto (Univerzitet
u Saseksu, Velika Britanija), Robert Kerl i Ričard Smoli (Rajs Univerzitet iz Hjustona) 1996.
godine dobili su Nobelovu nagradu.
Jedinjenja
Broј poznatih јedinjenja ugljenika јe preko 10 puta veća od poznatih јedinjenja svih ostalih
elemenata. Sem organskih јedinjenja veliki značaј imaјu ugljenik(II)oksid, ugljenik(IV)oksid,
ugljena kiselina, karbidi i karbonati.
Ugljenik(II)-oksid, CO, gas bez boje, ukusa i mirisa, veoma je otrovan, nastaje nepotpunim
sagorevanjem benzina i ostalih organskih jedinjenja
2C + O2 → 2CO
Biološki značaj
Posle vode ugljenik je najzastupljenija komponenta živih sistema. 49% suve materije
organizma čini ugljenik. Ugljenik kruži u atmosferi u obliku CO2 ka autotrofnim biljkama a
od njih, do konzumenata heterotrofa pri čemu se aerobnim disanjem veliki deo ugljenika
vraća u atmosferu takođe u obliku CO2.Ugljenik ulazi u sastav svih biološki značajnih
molekula kao što su šećeri, proteini, nukleinske kiseline, lipidi itd.
Upotreba
Grafit se upotrebljava za izradu olovaka i elektroda. To je jedini nemetal koji dobro provodi
električnu struju i toplotu.Aktivni ugalj se koristi za prečišćavanje vode i vazduha kao i za
apsorpciju gasova i para. Veštački dijamanti se koriste u industrijske svrhe za sečenje,
brušenje i poliranje drugih mekših materijala. Sečenjem i poliranjem dijamanata dobija se
brilijant koji se koristi kao nakit
Azot
Želiš da pročitaš svih 16 strana?
Prijavi se i preuzmi ceo dokument.
Slični dokumenti

Ovaj materijal je namenjen za učenje i pripremu, ne za predaju.