
Fizička hemija (ravnoteža faza) Pregled
45
RAVNOTEŽA FAZA
1. Faza
Faza je svaki hemijski i fizi
č
ki homogeni deo sistema koji je od
drugih delova sistema odvojen granicom na kojoj dolazi do nagle
promene hemijskih ili fizi
č
kih svojstava.
Č
vrsta, te
č
na ili gasna.
p – broj faza: jednofazni ili homogeni sistem, višefazni ili heterogeni
sistem. Tako voda koja sadrži komadi
ć
e leda predstavlja heterogen ili
dvofazni sistem.
2. Komponenta
Komponente su oni sastavni delovi sistema
č
ije se koncentracije
mogu nezavisno menjati a da ne do
đ
e do promene broja faza u sistemu.
c – broj komponenti: najmanji broj hemijskih sastojaka pomo
ć
u
kojih može da se opiše sastav svake faze koja se nalazi u ravnoteži.
Te
č
na
voda
u
ravnoteži
sa
svojom
parom
predstvalja
jednokomponentni, dvofazni sistem.
Ako u sistemu postoji i neka hemijska ravnoteža, broj komponenata se
dobija umanjenjem broja sastojaka za broj prisutnih ravnoteža:
3
2
CaCO (s)
CaO(s) + CO (g)
č
vrsta faza 1
č
vrsta faza 2
gasna faza
→
←
→
+
←
prisutne su tri faze (dve
č
vrste i jedna gasna), tri hemijska sastojka
(CaCO
3
, CaO i CO
2
) i dve komponente (CaO i CO
2
).
46
3. Stepeni slobode
Broj stepeni slobode, f, je najmanji broj intezivnih veli
č
ina (kao što
su pritisak, temperatura i koncentracije komponenata)
č
ija promena u
odre
đ
enim granicama ne dovodi do promene broja faza u ravnoteži.
USLOVI RAVNOTEŽE FAZA
- ravnoteža je termodinami
č
ka.
Ravnotežni uslovi za razne oblike ravnoteže izme
đ
u faza
α
i
β
:
Oblik
ravnoteže
Ekstenzivni
parametar
Intenzivni
parametar
Ravnotežni
uslov
Toplotna
S
T
T
T
α
β
=
Mehani
č
ka
V
P
P
P
α
β
=
Hemijska
n
i
µ
i
i
i
α
β
µ
µ
=
1. Toplotna ravnoteža
- temperature svih prisutnih faza su iste, ina
č
e bi se toplota prenosila
iz jedne faze ka drugoj.
Sistem od dve faze,
α
i
β
, na temperaturama
i
T
T
α
β
sa entropijama
i
S
S
α
β
. Uslov ravnoteže za stalnu zapreminu i sastav dat je kao
d
0
S
=
:
d = d
d
0
S
S
S
+
=
α
β
d
d
0
q
q
T
T
α
β
−
+
=
Rešavanjem ove jedna
č
ine dobija se :
T
T
α
β
=

48
Ukupan broj promenljivih je stoga zbir promenljivih koje odre
đ
uju
sastav svake faze pc, uve
ć
an za T i P, odnosno to je:
2
pc
+
Ako se umesto broja molova komponente
i
u fazi
α
, upotrebi molski
udeo
α
i
X
:
i
i
i
i
n
X
n
α
α
α
=
∑
Zbir molskih udela u svakoj fazi je:
∑
=
1
α
i
X
tako da po jedan molski udeo u svakoj fazi višekomponentnog sistema
može da se izra
č
una na osnovu prethodne jedna
č
ine, pa je ukupan broj
nezavisno promenljivih:
2
pc
p
+ −
ili (
1)
2
p c
− +
.
Uslov za ravnotežu faza zahteva jednakost hemijskih potencijala
komponenata u svim fazama:
1
1
1
2
2
2
3
3
3
....
....
....
α
β
γ
α
β
γ
α
β
γ
µ
µ
µ
µ
µ
µ
µ
µ
µ
=
=
=
=
=
=
=
=
=
Svaka ravnoteža (znak jednakosti) predstavlja uslov koji je nametnut
sistemu smanjuju
ć
i mu stepene slobode. Ovakvih uslova ima ukupno
c(p–1), tako da je sada broj stepena slobode:
)
1
(
2
)
1
(
−
−
+
−
=
p
c
c
p
f
Sre
đ
ivanjem ovoga izraza dobija se Gibsovo pravilo faza:
2
f
c
p
= − +
49
DIJAGRAMI STANJA
- su grafi
č
ki prikazi uslova ravnoteže izme
đ
u razli
č
itih faza
heterogenog sistema. Fazni dijagrami ili ravnotežni dijagrami.
Dve osnovne jedna
č
ine koje se koriste za dobijanje dijagrama stanja:
- Gibsovo pravilo faza (kvalitativni opis) i
- Klapejron-Klauzijusova jedna
č
ina (kvantitativni opis).
Klapejron-Klauzijusova jednačina
- kvantitivni prikaz empirijskog Le Šateljijevog principa primenjenog
na heterogene sisteme.
Uslov hemijske ravnoteže izme
đ
u dve faze (
α
i
β
) komponente i je
i
i
α
β
µ
µ
=
. Za jednokomponentne sisteme u ravnoteži:
G
G
α
β
=
.
Za ravnotežna stanja, 1 i 2, koja se me
đ
usobno malo razlikuju u
pritisku i temperaturi, ravnoteža je definisana na slede
ć
i na
č
in:
1.
,
T P
,
G
G
α
β
=
2.
d ,
d
T
T
P
P
+
+
d
d
G
G
G
G
α
α
β
β
+
=
+
Pošto je
G
G
α
β
=
dobija se:
d
d
G
G
α
β
=
Kako je
d
d
d
G
V P
S T
=
−
, sledi:
d
d
d
d
V
P
S
T
V
P
S
T
α
α
β
β
−
=
−
ili
d
d
fp
S
P
S
S
T
V
V
V
β
α
β
α
∆
−
=
=
∆
−
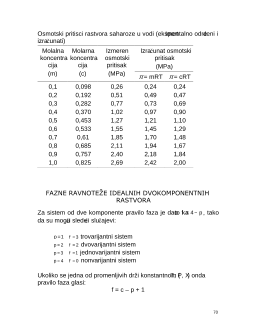
51
i predpostavi da se gas idealno ponaša (
V
RT P
=
):
2
2
d
d
d
ili
d
vap
vap
b
b
HP
H T
P
P
T
P
T R
T R
∆
∆
= −
= −
2
d ln
d
vap
H
P
T
RT
∆
= −
što se u opštem obliku može napisati:
d ln
d(1
)
fp
H
P
T
R
∆
= −
Zavisnost
ln
(1
)
P
f
T
=
daje pravu sa nagibom
fp
H
R
∆
−
.
Za konstantnu vrednost
H
fp
∆
, integraljenjem se dobija:
2
1
2
1
1
1
ln
fp
H
P
P
R
T
T
∆
= −
−
- mogu
ć
nost izra
č
unavanja promene entalpije datog faznog prelaza na
osnovu poznatih T
1
, P
1
, T
2
, P
2
, ili T
i
odnosno P
i
ako su ostale veli
č
ine
poznate.
Približna vrednost promene entalpije isparavanja može da se dobije iz
Trutonovog pravila:
88 J K mol
vap
b
H
T
∆
≈
gde se odnos
vap
b
H
T
∆
naziva Trutonovom konstantom.
Želiš da pročitaš svih 36 strana?
Prijavi se i preuzmi ceo dokument.
Slični dokumenti

Ovaj materijal je namenjen za učenje i pripremu, ne za predaju.


























































