
Freoni i životna sredina Pregled
Univerzitet Educons
Fakultet zaštite životne sredine
Sremska Kamenica
SEMINARSKI RAD IZ PREDMETA OPASNE I ŠTETNE MATERIJE
FREONI I ŽIVOTNA SREDINA
STUDENTI:
Milan Stojanović
Milan Panić
PREDMETNI NASTAVNIK:
Prof. dr Mira Pucarević
Novi Sad, novembar 2012.
2
Sadržaj
Uvod............................................................................................................................................3
Freoni..........................................................................................................................................4
Upotreba.....................................................................................................................................6
Uticaj na životnu sredinu............................................................................................................8
4
Freoni
Freoni su organska jedinjenja iz porodice haloalkana koja mogu da se podele u tri
osnovne grupe:
CFC (potpuno halogenizovani hlorofluorougljenici),
HCFC (delimično halogenizovani hidrohlorofluorougljenici) i
HFC (delimično halogenizovani hidrofluorougljenici).
Hlorofluorougljenici (CFC) su derivati metana i etana, sadrže hlor, fluor i ugljenik, pa im
je opšta formula CCl
m
F
4-m
ili C
2
Cl
m
F
6-m
. U pitanju su netoksične i nezapaljive supstance, koje se
ubrajaju među najstabilnija hemijska jedinjenja. Karakterišu se izuzetno niskim tačkama
ključanja (u poređenju sa drugim ugljovodonicima iste molekulske mase), koje su približno
iste ili čak i niže od tačaka ključanja alkana sa istim brojem atoma ugljenika.
[3,4]
Kada je u pitanju dobijanje CFC freona, zbog velike reaktivnosti fluor se ne može
direktno uvesti u molekule alkana, osim ako se pomeša sa azotom i upotrebi bakar kao
katalizator. Tada nastaje smeša različitih fluorovih derivata. Na primer, ako je prisutan samo
metan, dobijaju se CH
3
F, CH
2
F
2
, CHF
3
, CF
4
, C
2
F
6
i C
3
F
8
. S druge strane, etan daje CF
4
, C
2
F
6
,
CH
3
CHF
2
i CH
2
F–CHF
2
.
[3]
Fluorovi derivati se mogu dobiti i indirektno, zagrevanjem halogenskih derivata alkana
sa neorganskim fluoridima. Na primer:
CH
3
–CCl
3
+ 3 HF
→
CH
3
–CF
3
+ 3 HCl
Za ovu svrhu najviše se upotrebljava antimon-pentafluorid, SbF
5
, ili antimon-trifluorid,
SbF
3
:
CCl
4
+ SbF
5
→
CCl
3
+ SbF
4
Cl; SbF
4
Cl + SbF
3
→
SbF
5
+ SbF
2
Cl
CCl
3
+ SbF
5
→
CCl
2
F
2
+ SbF
4
Cl
3 CCl
4
+ SbF
3
→
3 CCl
3
F + SbCl
3
3 CCl
3
F + SbF
3
→
3 CCl
2
F
2
+ SbCl
3
Regeneracija SbF
3
postiže se hemijskom reakcijom sa HF:
[3]
SbF
2
Cl + HF
→
SbF
3
+ HCl
Dihlor-difluor-metan (freon-12), CCl
2
F
2
, je gas bez boje, mirisa i ukusa, lako prelazi u
tečnost koja ključa na -29,8°C. Nije zapaljiv, netoksičan je i ne napada metale. Koristio se
5
umesto amonijaka i ugljen-dioksida za rashladne uređaje (najčešće u kućnim frižiderima i
klima uređajima).
[3]
Hlor-difluor-metan (freon-22), CHClF
2
, dobija se dejstvom fluorovodonika na
hloroform:
[3]
2 HF + CHCl
3
→
CHClF
2
+ 2 HCl
To je bezbojan gas koji ključa na -40,8°C.
[3]
1,2-Dihlor-1,1,2,2-tetrafluor-etan (freon-114), CClF
2
–CClF
2
, dobija se dejstvom
antimon-fluorida na heksahlor-etan itd.
[3]
Da bi se izbacila iz upotrebe rashladna sredstva na bazi CFC koja imaju veliki potencijal
za oštećenje ozonskog omotača (ODP = 1), razvijena su nova (prelazna) rashladna sredstva,
odnosno delimično halogenizovani hidrohlorofluorougljenici (HCFC) sa mnogo manjim
potencijalom za uništavanje ozona (ODP oko 0,02). HCFC freoni sadrže vodonik, hlor, fluor i
ugljenik, pa je opšta formula ovih jedinjenja CCl
m
F
n
H
4-m-n
ili C
2
Cl
x
F
y
H
6-x-y
. U „prelazne“ freone
spadaju, između ostalih, R21, R22 (koji se najmasovnije koristi), R122, R123, R141, R141b,
R142, R142b i drugi.
[3,4]
Delimično halogenizovani hidrofluorougljenici (HFC) sadrže samo vodonik, fluor i
ugljenik. Njihova opšta formula glasi CF
m
H
4-m
, C
2
F
m
H
6-m
, C
3
F
m
H
8-m
ili C
4
F
m
H
10-m
. Ovi freoni imaju
iste termodinamičke osobine kao CFC freoni, ali u daleko manjoj meri oštećuju ozon jer ne
sadrže atome hlora.
[3,4]
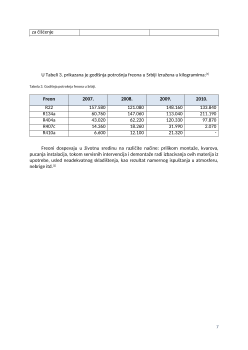
U Tabeli 1. dat je pregled osnovnih vrsta freona i njihovih hemijskih formula.
Tabela 1. Pregled osnovnih vrsta freona.
Naziv
Oznaka
Formula
Trihlorofluorometan
Freon-11, R-11, CFC-11
CCl
3
F
Dihlorodifluorometan
Freon-12, R-12, CFC-12
CCl
2
F
2
Hlorotrifluorometan
Freon-13, R-13, CFC-13
CClF
3
Hlorodifluorometan
R-22, HCFC-22
CHClF
2
Dihlorofluorometan
R-21, HCFC-21
CHCl
2
F
Hlorofluorometan
Freon 31, R-31, HCFC-31
CH
2
ClF
Bromohlorodifluorometan
BCF, H-1211, Freon 12B1
CBrClF
2
1,1,2-Trihloro-1,2,2-trifluoroetan
Freon 113, R-113, CFC-113
Cl
2
FC-CClF
2
1,1,1-Trihloro-2,2,2-trifluoroetan
Freon 113a, R-113a, CFC-113a Cl
3
C-CF
3
1,2-Dihloro-1,1,2,2-tetrafluoroetan
Freon 114, R-114, CFC-114
ClF
2
C-CClF
2
1-Hloro-1,1,2,2,2-pentafluoroetan
Freon 115, R-115, CFC-115
ClF
2
C-CF
3
2-Hloro-1,1,1,2-tetrafluoroetan
R-124, HCFC-124
CHFClCF
3
1,1-Dihloro-1-fluoroetan
R-141b, HCFC-141b
Cl
2
FC-CH
3
1-Hloro-1,1-difluoroetan
R-142b, HCFC-142b
ClF
2
C-CH
3
Tetrahloro-1,2-difluoroetan
Freon 112, R-112, CFC-112
CCl
2
FCCl
2
F
Tetrahloro-1,1-difluoroetan
Freon 112a, R-112a, CFC-112a CClF
2
CCl
3
1,1,2-Trihlorotrifluoroetan
Freon 113, R-113, CFC-113
CCl
2
FCClF
2
Želiš da pročitaš svih 18 strana?
Prijavi se i preuzmi ceo dokument.
Slični dokumenti

Ovaj materijal je namenjen za učenje i pripremu, ne za predaju.


























































