
Gas i gasni zakoni Pregled
Univerzitet u Novom Sadu
Tehnički fakultet „Mihajlo Pupin“
Zrenjanin
SEMINARSKI RAD
TEMA:
Gas I gasni zakoni
predmet:
Karakteristike naftnog I gasnog sloja
profesor:
Mićić Radoslav
student:
Gaćinović Marko
broj indeksa:
NG 17/14
smer:
industrijsko inženjerstvo u eksploataciji nafte i gasa
semestar:
zimski
18.januar 2017.
SADRŽAJ:
1.Uvod
2.Idealno gasno stanje
3.Bojl-Mariotov zakon
4.Gej-Lukasov zakon
5.Klajperonova jednačina
6.Daltonov zakon
7.Amagatov
8.Gremov
9.Avogadrov
10.Literatura
Seminarski rad
Marko Gaćinović NG 17/14
2.IDEALNO GASNO STANJE
Upoznavanju gasnog stanja doprinela je ideja o idealnom gasu, u kome su
zapremine molekula i međumolekulska dejstva zanemarljivi. Ovakav gas je hipotetičan,
ali se u određenim uslovima realni gasovi ponašaju približno idealnim, pa su se analogije
između idealnih i realnih gasova pokazale veoma korisnim za definisanje gasnog stanja.
Osnovne osobine gasnog stanja otkrivene su empirijski, na osnovu posmatranja
zbivanja u celoj zapremini gasa.
Tako su formulisani: Bojl Mariotov (
Boyle-Mariotte
) zakon.
Gej Lisakov (
Gay Lussac
) zakon.
Šarlov (
Jacques Charles
) zakon.
Daltonov (
Dalton
) zakon.
Amagatov (
Amagat
) zakon.
Gremov (
Graham
) zakon.
Avogadrov (
Avogadro
) zakon.
Nelogičnost da je hipotetično gasno stanje moglo biti ispitano eksperimentalnim
putem može se objasniti činjenicom da se jedan broj gasova u uobičajenim radnim
uslovima ponaša približno idealno, kao i manjom osetljivošću eksperimentalnih metoda u
prvim ispitivanjima.
Ove zakonitosti potvrđene su kinetičkom teorijom gasova izvedenom na osnovu
teorijskih predpostavki o ponašanju svakog pojedinačnog molekula idealnog gasa.
- 4 -
Seminarski rad
Marko Gaćinović NG 17/14
3.BOJL-MARIOTOV ZAKON
ROBERT BOYLE, (1627-1691)
je bio “eksperimentalni filozof”
ranog perioda Kraljevskog društva.
Dao je važan doprinos razvoju
koncepta idealnog gasnog stanja
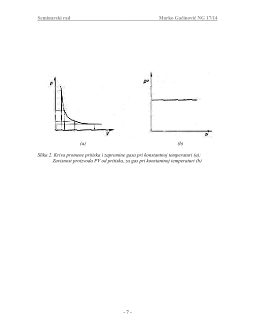
Pritisak određene količine gasa zavisi od temperature i zapremine u kojoj se gas
nalazi. Ako se jedna od ovih veličina izmeni, npr. temperatura, promeniće se i druge dve
veličine. Iz ovog se zaključuje da za određenu količinu gasa, ako su poznate dve od tri
promenljive
P, V, T
(pritisak, zapremina i temperatura), može da se izračuna treća, pod
uslovom da nam je poznato na koji način zavise ove tri veličine jedna od druge. Uopšte,
ta zavisnost može da se izrazi funkcijom:
F
(
P
,
V
,
T
) = 0
koja predstavlja opšti oblik jednačine idealnog gasnog stanja. Naći ovu funkciju znači
naći zakone po kojima se gasovi vladaju. Tri promenljiva parametra: pritisak, zapremina i
temperatura, su potrebni i dovoljni za definiciju stanja gasova.
Engleski naučnik Robert Bojl (Robert Boyle, 1627—1691) našao je prvi zakon
gasnog
stanja (1660. god.), eksperimentalnim putem. Nezavisno od njega do istog zakona došao
je francuski fizičar E. Mariot (E. Mariotte, 1620—1684), 17 godina kasnije.
Eksperiment za izvođenje ovog zakona sastoji se od dve birete spojene gumenim
crevom i napunjene približno do polovine živom (sl. 1). Leva bireta na gornjem kraju ima
slavinu. Ako se slavina zatvori pri izjednačenim nivoima u obe birete, nad živom će se
nalaziti vazduh pod atmosferskim pritiskom. Kada se desna bireta izdigne toliko da
razlika gasova u obe birete bude 76 cm, gas u levoj bireti nalaziće se pod pritiskom
dvaput većim od početnog. Pri tom će se opaziti da će zapremina gasa u levoj bireti biti
polovina prvobitne zapremine. Ako se desna bireta spusti toliko da razlika nivoa bude 38
cm, gas u levoj bireti biće pod pritiskom upola manjim od početnog, pri čemu će
zapremina biti dva puta veća od prvobitne.
- 5 -
Želiš da pročitaš svih 17 strana?
Prijavi se i preuzmi ceo dokument.
Slični dokumenti

Ovaj materijal je namenjen za učenje i pripremu, ne za predaju.


























































