
Gasno stanje materije Pregled
УНИВЕРЗИТЕТ У НИШУ
ФАКУЛТЕТ ЗАШТИТЕ НА РАДУ
Предмет: Хемијски параметри радне и животне средине
Семинарски рад
Гасно стање материје
Ниш, јануар 2013.
Ментор:
Студенти:
Проф. др Амелија Ђорђевић, доцент
Стаменковић Милан 12060
Младеновић Јована 12064
Лазић Сања 12067
Садржај
Увод............................................................................................................................................1
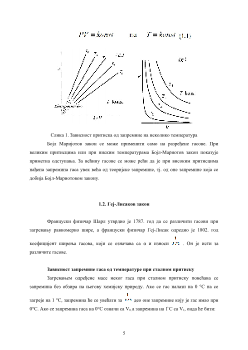
1.1. Бојл-Мариотов закон.........................................................................................................4
1.2. Геј-Лисаков закон..............................................................................................................5
1.3. Шарлов закон.....................................................................................................................7
1.4. Једначина идеалног гасног стања - Kлајперонова једначина........................................9
1.5. Парцијални притисци гасова..........................................................................................10
1.6. Авогадров закон...............................................................................................................11
1.7. Кинетичка теорија гасова................................................................................................12
Закључак..................................................................................................................................14
Литература..................................................................................................................
.
............15
У гасовитом стању привлачне силе међу честицама знатно су слабије од
њихове топлотне енергије па се честице скоро слободно крећу испуњавајући
целокупан расположиви простор.
1. Гасно стање материје
За гасове је карактеристично, за разлику од чврстих и течних супстанци да
постоји одређен однос између густине разређених гасова и молекулских тежина. У
хемији је тај однос искоришћен за израчунавање атомских тежина, затим за одређивање
гасних густина супстанци, чији је молекулски сатав познат, или за одређивање
молекулских тежина гасова из њихових густина код гасова чији је молекулски састав
непознат. Гасни закони се примењују и у квантитативној анализи.
Од свих стања материје гасно је најједноставније. Гасови се упадљиво
разликују од течности и чврстих супстанција особином да је њихова запремина у
великој мери зависна од притиска и температуре. Запремина одређене количине
течности се незнатно мења при промени притиска и температуре. Повећањем притиска
од 1 на 2 атмосфере запремина воде се смањује за 0,01 % а повишавањем температуре
од 0 до 100 °С запремина ваздуха се знатно повећава, и то око 36,6 °С. Дакле,
променама притиска и температуре запремина гасова се много мења, и то независно од
природе гаса.
Гасови су експанзивни, тј. способни да заузму запремину која им се стави на
располагање, гасови се могу лако компромитовати, они имају малу густину и незнатан
вискозитет.
Запремина гаса је одређена када су познати услови под којима се он налази. Ти
услови су температура и притисак. Према томе, стање гаса карактеришу три основне
величине:
температура,
притисак и
запремина.
Арбитарно је усвојено да се температура од 0 °С и притисак од 1 атмосфере
сматрају као нормални услови. Код гасова се најчешће употребљава као јединица за
притисак 1 атмосфера.
2
Када се применом једначине гасног стања, код једног гаса који није под
нормалним условима, израчуна његова запремина под нормалним условима, каже се да
је запремина гаса редукована на нормалне услове.
Како се мере гасови? Чврсте супстанције се могу лако мерити на ваги. Течне
супстанције се могу мерити на ваги или преко запремине доћи до тежине ако се
запремина одговарајуће течности помножи са њеном специфичном тежином. Мерење
гаса на ваги није једноставно, с једне стране, зато што гасови имају мале специфичне
тежине, а с друге стране, зато што је одређивање специфичних тежина гасова доста
компликовано. Много је једноставније из запремине гаса под одређеним условима
израчунати тежину гаса. И ово је један од разлога због којих се гасно стање материје
изучава и у хемији. Гасни закони се односе на тзв. идеалне гасове, а обични или реални
гасови доста приближно следе гасне законе. При високим притисцима или ниским
температурама код реалних гасова гасни закони се не могу примењивати.
Гасови су корпускуларне природе, састављени из молекула који се слободно
крећу у простору. Гасни молекули, практично узевши, међусобно се не привлаче него
се слободно крећу у запремини која је знатно већа од стварне запремине гасних
молекула. Вандервалсове (Ван дер Валс) силе међусобног привлачења молекула код
разређених гасова се могу занемарити јер су гасни молекули удаљени једни од других.
Међутим, код компримованих гасова молекули су веома блиски једни другима и они се
привлаче. Због слободног кретања гасних молекула гасови немају ни сталаноблик ни
сталну запремину. Ударањем гасних молекула о зидове суда објашњава се гасни
притисак. Могућност експанзије и компресије гасова се објашњава променом
међумолекулског простора. Код идеалних гасова не би постојало привлачење међу
молекулима.
Код разређених гасова стварна запремина гасних молекула је врло мала и
представља једва хиљадити део запремине суда у коме се гас налази. Ово се може
следећим примером илустровати. Ако се измери 1g јода, чија је запремина у чврстом
стању 0,2 ml, па се иста количона чврстог јода преведе у стању паре, његова запремина
при 1 атмосфери и 184 °С износиће 148 ml, тј. биће око 700 пута већа него у чврстом
стању.
У идеалном гасном стању, гасови су мешљиви док је у другим стањима
мешљивост ограничена или уопште не постоји. Основне особине гасног стања
откривене су емпиријски, на основу посматрања збивања у целој запремини гаса. Тако
су формулисани:
3
Želiš da pročitaš svih 17 strana?
Prijavi se i preuzmi ceo dokument.
Slični dokumenti

Ovaj materijal je namenjen za učenje i pripremu, ne za predaju.


























































