Hemijska ravnoteža Pregled
HEMIJSKA RAVNOTEŽA
HEMIJSKA RAVNOTEŽA
http://www.ffh.bg.ac.rs/geografi_fh_procesi.html
HEMIJSKA RAVNOTEŽA - pregled
HEMIJSKA RAVNOTEŽA - pregled
Uslovi hemijske ravnoteže
Reverzibilne hemijske reakcije
Karakteristike hemijske ravnoteže
Termodinamička, formalna i koncentraciona konstanta ravnoteže
Hemijska ravnoteža u heterogenim sistemima
Le Šatelijeov princip
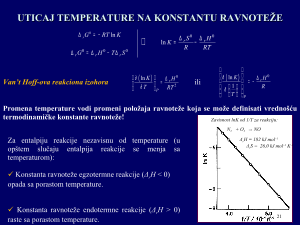
Uticaj temperature i pritiska na konstantu ravnoteže
Termodinamički uslov hemijske reakcije i konstanta ravnoteže
2

Hemijska ravnoteža je određena opštim termodinamičkim uslovima za ravnotežu sistema
:
Maksimum entropije pri uslovima konstante unutrašnje energije i temperature,
∆
S
U,T
= 0
Minimum unutrašnje energije pri uslovima konstantne zapremine i entropije,
∆
U
V,S
= 0
Minimum entalpije pri uslovima konstantnog pritiska i entropije,
∆
H
p,S
= 0
Minimim Helmholcove funkcije pri uslovima konstantne zapremine i temperature,
∆
A
V,T
= 0
Minimum Gibsove funkcije pri uslovima konstantnog pritiska i temperature,
∆
G
p,T
= 0
POVRATNE (REVERZIBILNE) HEMIJSKE REAKCIJE
POVRATNE (REVERZIBILNE) HEMIJSKE REAKCIJE
5
Povratna hemijska reakcija (reverzibilna reakcija) je hemijska reakcija u kojoj reaktanti
međusobno reaguju gradeći proizvode koji isto međusobno reaguju gradeći početne
reaktante.
Reverzibilna reakcija se sastoji od dve reakcije koje se odvijaju u suprotnim
smerovima:
direktna reakcija - reakcija stvaranja proizvoda iz reaktanata (najčešće reakcija “u
desno”)
povratna rekacija - reakcija stvaranja polaznih reaktanata iz njihovih proizvoda
(najčešće reakcija “u levo”)
Primer reverzibilne reakcije
:
NH
4
Cl(s)
⇄
NH
3
(g) + HCl(g)
Karakteristike ravnotežnog stanja:
Pri konstantnim uslovima ravnotežno stanje je nepromenljivo.
Ravnoteža je pokretna, jer ako promenom spoljašnjih uslova izazovemo malu promenu
ravnoteže, pri prestanku dejstva sistem će se vratiti ponovo u početno stanje.
Ravnoteži se može prići sa obe strane i od reaktanata i od produkata.
Ravnoteža je dinamička, pa su stoga značajni parametri koji utiču na brzinu reakcije.
7
Želiš da pročitaš svih 34 strana?
Prijavi se i preuzmi ceo dokument.
Slični dokumenti

Ovaj materijal je namenjen za učenje i pripremu, ne za predaju.