
Natrijum-karbonat i Natrijum-hidrogenkarbonat Pregled
NEORGANSKA HEMIJSKA TEHNOLOGIJA
SEMINARSKI RAD
TEMA:
Natrijum-karbonat i Natrijum-hidrogenkarbonat
Student: Mentor:
1.1. NATRIJUM-KARBONAT (SODA)
Natrijum-karbonat je poznat pod komercijalnim nazivom soda i posle natrijum-hlorida
predstavlja najznačajniju so natrijuma. Spada u red onih materija koje su poznate iz davnina. Do
19. veka proizvodila se skupa soda sa 3-30% Na
2
C0
3
iz luga koji se dobija iz žarenog pepela
određenih biljaka. Masovna proizvodnja sode počela je krajem 18. i početkom 19. veka Le
Blanovim postupkom (Le Blanc). U drugoj polovini 19. veka startuje proizvodnja Solvejevim
postupkom (E. Solvav), koji je u odnosu na Le Blanov tehnički i ekonomski savršeniji tako da je
poslednja fabrika po Le Blanovom postupku prestala sa radom 1923. god. Soda koja se proizvodi
Solvejevim postupkom naziva se često amonijačna soda.
Najznačajnije trgovačke vrste kalcinisanje sode (bezvodnog natrijum-karbonata) su „laka soda" i
„teška soda" koje se međusobno razlikuju po raspodeli veličina čestica a time i po nasipnoj
zapreminskoj masi. U hemijskom pogledu se ne razlikuju među sobom i kao tehnički proizvodi
imaju visoku čistoću i garantovan kvalitet sa najmanje 98% Na
2
C0
3
. Laka soda ima nasipnu
zapreminsku masu od 0,5-0,6 kg/l, a teška soda od 1,05-1,15 kg/l. U industriji se više koristi
teška soda pošto se manje praši i rasipa od lake. Teška soda se proizvodi iz lake sode, koja
direktno nastaje u procesu proizvodnje, na taj način što se vreloj sodi iz procesa kalcinacije
dodaje toliko vode da nastaje Na
2
C0
3
·H
2
0,koji se potom podvrgava dehidrataciji.
Pored navedenih trgovačkih vrsta proizvode se i specijalne vrste: teška zrnasta soda, granulisana
soda, briketirana soda. Jedan od proizvoda koji ima danas manji značaj je i „kristalna soda" tj.
dekahidrat Na
2
C0
3
· 10H
2
O koji kristališe iz vrelih zasićenih rastvora.
Soda je materija koja se proizvodi u velikim količinama i koristi u nizu grana hemijske industrije.
Upotrebljava se najčešće kao sredstvo za neutralizaciju i podešavanje pH vrednosti rastvora u
procesu, zbog svoje alkalne reakcije, i kao topitelj. Koristi se za izradu niza hemikalija kao što su
kriolit, perborat, fosfat, silikat i drugi, za sredstva za pranje i sapune, zatim u industriji celuloze,
papira, tekstila, stakla, keramike, hrane, neorganskih pigmenata, aluminijuma, za omekšavanje
vode, itd.
1.1.1. OSOBINE KALCINISANE SODE
Kalcinisana soda, i to naročito laka soda, vrlo je higroskopna materija i zato joj kod
transportovanja i lagerovanja, već zavisno od vremenskih uslova i načina držanja, rastu vlažnost i
sadržaj ugljene kiseline, što na površini dovodi do prelaza natrijum-karbonata u natrijum-
hidrogenkarbonat. Ovaj prelaz može pod nepovoljnim uslovima da dovede do porasta mase od
17%, pa se zato preporučuje da se soda lageruje u suvim zatvorenim prostorijama.
Kristalna soda ima težnju da se spraši ili topi, što zavisi od temperature i vlažnosti vazduha.
Zagrevanjem na temperaturu 32—33°C, ili iznad, topi se.
U sistemu H
2
0-Na
2
C03 postoje hidrati sa 1, 7 i 10 molekula vode, čije se rastvorijivosti mogu
očitati na sl. 1.
1
Od mnogih minerala koji sadrže Na
2
C0
3
jedino trona ima komercijalni značaj:
Trona Na
2
0
3
·NaHC0
3
·2H
2
0
Natron Na
2
CO
3
·10H
2
O
Termonatrit Na
2
C0
3
·1H
2
0
Hanksit 2Na
2
C0
3
·9Na
2
S0
4
·KCl
Pirsonit Na
2
C0
3
·CaC0
3
·2H
2
0
Gejlusit Na
2
CO
3
-CaCO
3
-S
2
O
Iz minerala se soda dobija luženjem i uparavanjem rastopa radi istaložavanja sode.
Prirodne lužine iz jezera tretiraju se ugljen-dioksidom radi obaranja natrijum-hi-
drogenkarbonata koji se filtrira, ispira i kalciniše u natrijum-karbonat. Drugi način dobijanja
prirodne sode izvodi se tako što se lužina izlaže suncu toliko dugo dok se ne stalože kristali trone
sa oko 45% Na
2
C0
3
, 35% NaHC0
3
, 2% NaCl, 1,5% Na
2
S0
4
, 0,1% Si0
2
, 0,2% nerastvorenog ostatka i
16% kristalne vode. Kalcinisanjem trone dobija se sirov proizvod sa 95-96% Na
2
C0
3
čijim se
prekristalisavanjem dobija čistija soda.
1.1.3. SOLVEJEV POSTUPAK PROIZVODNJE SODE
1.1.3.1. Princip i fizičko-hemijski osnovi postupka
Solvejev, ili amonijačni, postupak proizvodnje zasniva se na obrazovanju relativno teško
rastvornog natrrjum-hidrogenkarbonata (poznatog u industriji sode pod imenom bikarbonat)
uvođenjem ugljen-dioksida u rastvor natrijum-hlorida zasićen amonijakom. Bikarbonat se
obrazuje po reakciji:
NaCl + NH
4
HCO
3
= NaHCO
3
+ NH
4
Cl
Proces se može raščlaniti na sledeće stupnjeve:
1. Dobijanje zasićenog rastvora kuhinjske soli (tzv. sole)
2. Dobijanje kreča pečenjem krečnjaka(ugljen-dioksid koji pri tome nastaje koristi se u 4.
stupnju):
CaC0
3
= CaO + C0
2
3. Zasićenje rastvora kuhinjske soli sa amonijakom (amoniziranje)
3
4. Taloženje bikarbonata uvođenjem ugljen-dioksida iz 2. i 6. stupnja (karbonizacija).
Proces se može prikazati jednačinom:
NaCl + H
2
0 + NH
3
+ C0
2
= NH
4
CI
+ NaHC0
3
5. Filtriranje i pranje staloženog bikarbonata
6. Termičko razlaganje bikarbonata do natrijum-karbonata:
2NaHC0
3
= Na
2
C0
3
+ H
2
0 + C0
2
7. Pripravljanje krečnog mleka:
CaO + H
2
0 = Ca(OH)
2
8. Regeneracija amonijaka destilacijom matične lužine sa amonijum-hloridom posle
odvajanja bikarbonata, sa krečnim mlekom:
2NH
4
Cl + Ca(OH)
2
= 2NH
3
+ CaCl
2
+ 2H
2
0
Oslobođen amomjak vraća se u 3. stupanj, dok se zaostala lužina u najvećoj količini odbacuje, a
u manjoj po zahtevu tržišta prerađuje u kalcijum-hlorid. Natrijum-karbonat ne može da se dobije
direktnom reakcijom:
2NaCI + CaC0
3
= Na
2
C0
3
+ CaCl
2
jer se u vodenom rastvoru zbog taloženja teškog rastvornog kaleijum-karbonata reakcija
praktično odvija s desna ulevo. Zato se proces vodi posredno preko međuprodukta NH
4
HC0
3
koji
treba da omogući obrazovanje natrijum-hidrogenkarbonata.
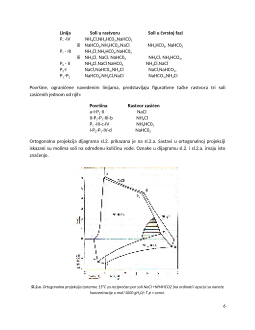
Reakcija koja se odvija u vodenom rastvoru-određena je rastvorljivošcu pojedinih soli u
prisustvu drugih. U ovom vodenom rastvoru sa recipročnim parom soli, tj. sistemu sa dvogubom
izmenom, reč je o kvarternom sistemi u smislu Gibsovog pravila faza.
Odnose rastvorljivosti u sistemima sa jednom, dve i tri soli iz reakcionog sistema ispitivao je
između ostalih Fedotjev, na osnovu kojih je postavio prostorni dijagram rastvorljivosti na
temperaturi 15°C, shematski prikazan na sl.2.
4

Želiš da pročitaš svih 20 strana?
Prijavi se i preuzmi ceo dokument.
Slični dokumenti

Ovaj materijal je namenjen za učenje i pripremu, ne za predaju.


























































