Neorganska hemija Pregled
NEORGANSKA HEMIJA
2
Definicije:
Hemijska veza
- je privlačna sila između dva atoma nastala interakcijom njihovih perifernih
elektrona
Jonska veza
- nastaje reakcijom izrazitih metala koji u valentnom nivou imaju mali
broj elektrona (Ia i IIa grupa) i nemetala koji u valentnom nivou imaju veliki broj elektrona (VIIa
grupa) periodnog sistema elemenata. Atomi metala otpuštaju elektrone koje primaju
atomi nemetala. Broj primljenih elektrona jednak je broju otpuštenih elektrona. Ovaj proces
otpuštanja i primanja elektrona naziva se oksido-redukcija, a ponekad i jednostavno oksidacija.
Kovalentna veza
se obrazuje između atoma nemetala, stvaranjem
zajedničkih elektronskih parova. Kovalentna veza može biti polarna, nepolarna i koordinantna (u
zavisnosti od toga atomi kojih hemijskih elemenata stupaju u vezu).
Nepolarna kovalentna veza podrazumeva da se elektronski parovi jednako privlače jezgru
atoma u molekulu (O
2
,N
2
,CH
4
, ...)
Polarna kovalentna veza podrazumeva da elektronski par privlači više jedno jezgro atoma od
drugog. (HCl, HF, HBr, ...)
Koordinantna veza podrazumeva da elektronski par daje samo jedan atom (donor), drugi
atom se naziva akceptor (NO, SO
2
, SO
3
, ...)
Metalna veza
je veza između atoma metala. Osnovna privlačna sila koja djeluje između atoma
metala uzrokovana je uzajamnim djelovanjem metalnih iona i zajedničkog elektronskog oblaka.
Svi atomi su postali pozitivni ioni koje čvrsto veže jedan oblak delokaliziranih elektrona.
Metalna veza nije usmjerena u prostoru .
Vodonična veza
(H-veza)
je vrsta slabe hemijske veze zasnovane na elektrostatičkom
privlačenju između atoma vodonika i nekog nukleofilnog atoma koji sadrži slobodne elektronske
parove. Ova veza je moguća kada je vodonik povezan kovalentnom vezom sa atomom velike
elektronegativnosti (npr. kiseonik, fluor, azot) pri čemu se parcijalno naelektrisanje jako
delokalizuje na krajevima malih, kompaktnih molekula ovog tipa. Iako komparativno slaba,
vodonična veza je oko 5 puta jača od drugih, standardnih interakcija tipa dipol-dipol.
elementa je raspored elektrona koji pripadaju atomu datog elementa
na njegovim elektronskim orbitalama. Brojevi koji se javljaju ispred slova označavaju energetske
nivoe. Njihova numerizacija počinje od orbitale najbliže jezgru i raste sa odaljavanjem od njega.
Mala slova ("s", "p", "d" i "f") označavaju vrste orbitala, a gornji brojevni indeksi označavaju
broj elektrona koji se nalaze na datoj orbitali.
Opšta pravila uspostavljanja konfiguracije:
Prvo se popunjava orbitala "s", zatim "p", zatim "d", pa "f" i na kraju "g".
Orbitale na višim energetskim nivoima popunjavaju se tek kad se popune niži energetski nivoi.
Na orbitali s mogu da budu samo 2 elektrona, na p 6, na d 10, na f 14, na g 18.
Na prvom energetskom nivou postoji samo orbitala s, na drugom energetskom nivou orbitale s i

4
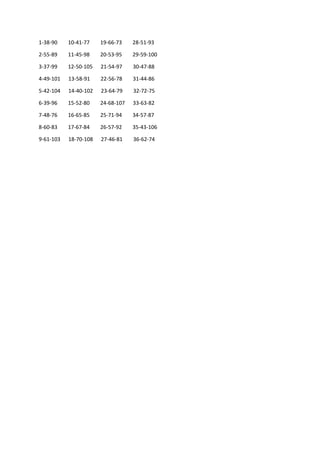
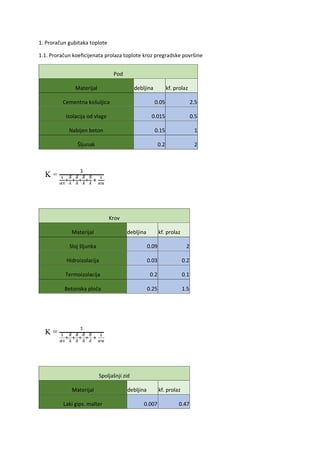
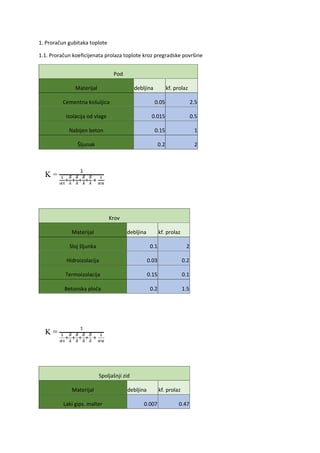
1. Periodična promjena veličine atoma u PSE
U periodnom sistemu atomi teže povećavanju atomskog radiijusa idući kroz periode prema dolje
te smanjuju idući s lijeva na desno kroz grupe hemijskih elemenata.Kao posljedica toga najmanji
atom po atomskim radijusima jeste helijum sa radijusom od 32 pikometra,dok je jedan od
najvećih cezijum sa 225 pikometra.
2. Šta se podrazumijeva pod pojmom „lantoidna kontrakcija“ ?
Lantoidna kontrakcija je izraz u hemiji kojim se objašnjavaja pojava smanjenja jonskog
poluprečnika lantanoida tj. elemenata sa atomskim brojevima od 58 do 71. Uzrok lantoidne
kontrakcije je slabo zaklanjanje od strane 4f- elektrona.
3. Na čemu se zasniva podjela elemenata na metale,nemetale i semimetale?
Na osnovu zajedničkih fizičkih i hemijskih svojstava, elementi su klasifikovani na
metale,nemetale i semimetale.
4. Elektronegativnost – definicija,trend promjena ovog parametra u PSE
Elektronegativnost (χ) je mjera za tendenciju privlačenja elektrona preko atoma datog
elementa,kada on gradi molekul sa atomima drugih elemenata. Hemijski element sa većom
elektronegativnošću „dovlači“ do sebe elektrone koji grade drugog atoma što dovodi do
polarizacije jedinjenja.
Elektronegativsnost je periodično svojstvo, mjenja se sa promjenom atomskog broja. Iduući u
periodi s lijeva na desno dolazi do povećanja koeficijenata elektronegativnosti.
5. Objasniti hibridizacije sp , sp
2
i sp
3
Hibridizacija je koncept mješanja atomskih orbitala pri čemu se formiraju nove hibridne orbitale.
Kada gradi trostruku vezu, svaki ugljenikov atom je vezan za dva druga atoma, odnosno svaki
ugljenikov atom gradi dve sigma (σ) veze, za čije su građenje potrebna dva elektrona. Zbog toga
se pretpostavlja da se po prelasku jednog elektrona iz 2s u 2p orbitalu (pobuđeno stanje), u ovom
slučaju hibridizuju samo dve orbitale, i to jedna s i jedna p orbitala, i postaju dve ekvivalentne
sp-hibridne orbitale.
Dakle, kombinacija jedne s i jedne p orbitale naziva se sp-hibridizacija. Dve sp– hibridne orbitale
svakog ugljenikovog atoma orijentisane su tako da zaklapaju ugao od 180°; na taj način one su
najudaljenije jedna od druge. Na svakom ugljenikovom atomu ostaju još po dve nepromenjene p
orbitale sa po jednim elektronom. One se međusobno orijentišu tako da su normalne jedna u
odnosu na drugu. Kada je nagrađena sigma (σ) veza, ove orbitale su dovoljno blizu tako da se
bočno preklapaju gradeći dve pi (π) veze. Sp-hibridizacija ugljenika najjednostavnije se može
objasniti na primeru molekula etina (HC≡CH).
5
SP
2
-hibridizacija ugljenika najjednostavnije se može objasniti na primeru molekula etena
(H2C=CH2). Svaki ugljenikov atom etena vezan je za tri druga atoma; da bi se nagradile ove
veze potrebna su po tri elektrona na svakom ugljenikovom atomu. Zbog toga je pretpostavljeno
da se, posle prelaska jednog s elektrona u p orbitalu (pobuđeno stanje), hibridizuju samo tri
orbitale (jedna s i dve p) dajući tako tri ekvivalentne sp
2
-hibridne orbitale. Ovakav postupak
hibridizacije jedne s i dve p orbitale naziva se sp
2
-hibridizacija.
Tri sp
2
-hibridne orbitale svakog sp
2
-hibridizovanog ugljenikovog atoma, u težnji da se što više
udalje jedna od druge, orijentišu se tako da se sve tri nalaze u jednoj ravni pod uglovima od
120°. Na svakom ugljenikovom atomu ostaje po jedan elektron u pz orbitali koja nije
učestvovala u hibridizaciji. Te pz orbitale nalaze se normalno na ravan u kojoj su sp
2
-hibridne
orbitale oba ugljenikova atoma. Kod etena, oba ugljenikova atoma i sva četiri vodonikova atoma
nalaze se u jednoj ravni što znači da je molekul planaran.Pošto se nagradi sigma (σ) veza između
ugljenikovih atoma (čeonim preklapanjem dve sp
2
-hibridne orbitale), dve pz orbitale nalaze se
doboljno blizu, i kada među sobom postanu paralelne (oko sigma veze postoji slobodna rotacija)
one se bočno preklapaju i grade kovalentnu vezu koja se naziva pi (π) veza. Kovalentna veza
koja nastaje bočnim preklapanjem orbitala naziva se pi (π) veza, a elektroni koji grade tu vezu
nazivaju se pi (π) elektroni. Kako je bočno preklapanje relativno manje nego preklapanje duž
ose, kao što je kod sigma (σ) veze, to je pi (π) veza slabija nego sigma (σ) veza. Dakle, dvostruka
veza se sastoji iz jedne pi (π) i jedne sigma (σ) veze (za razliku od jednostruke veze gde je
prisutna samo sigma (σ) veza), i kao celina je jača od jednostruke veze.
Na osnovu elektronske konfiguracije ugljenika (1s
2
, 2s
2
, 2px
1
, 2py
1
) ugljenik bi mogao da gradi
samo dve kovalentne veze. To je, međutim, u suprotnosti sa eksperimentalnim činjenicama na
osnovu kojih se zna da je ugljenik u svojim stabilnim jedinjenjima četvorokovalentan, i da su

7
6. Vodonik – hemijska svojstva elememta i jedinjenja
Vodonik je na sobnoj temperaturi gas bez boje mirisa i ukusa.Najlakši je od svih gasova, a
tekući vodonik je najlakša tekućina.Tačka topljenja i tačka ključanja su mu veoma niski, iz čega
se izvodi zaključak da su međumolekulske sile veoma slabe.Elektronski par molekule vodonika
ravnomjerno je raspoređen između dva atoma vodonika. Samo He ima nižu tačku ključanja od
vodonika. Molekula vodonika sastoji se od 2 atoma povezana kovalentnom vezom. To je najjača
od svih jednostrukih veza između dva istovrsna atoma. Kada molekul H
2
reaguje sa drugim
elementima, jedan od stepena reakcije je raskidanje H-H veze. Zbog velike energije koju je
potrebno utrošiti za ovaj stepen, vodonik sa drugim elementima reaguje dovoljno brzo pri
visokim temperaturama.Pri običnoj temperaturi vodonik nije posebno reaktivan.Molekula H
2
može redukovati kisele rastvore premanganata i hlorata. Vodonik je aktivniji u atomskom nego u
molekulskom obliku,a razlog je ušteda energije potrebne za razaranje molekule.
Dobijenje:
Laboratorijski vodonik se najčešće dobija u Kipovom aparatu reakcijom cinka sa razrijeđenom
HCl ili H
2
SO
4
Zn + HCl → ZnCl
2
+ H
2
Djelovanjem vode na čvrste hidride, najčešće kalcijum hidrid :
CaH
2
+ 2H
2
O → Ca(OH)
2
+ 2H
2
Reakcijom metala sa bazama :
2Al + 6H
2
O + 2OH
-
→ 2Al (OH)
4
-
+ 3H
2
Elektrolizom vode :
H
2
O ↔ H
+
+ OH-
K(-) : 4H
+
+ 4e
-
→ 4H → 2H
2
A(+) : 4OH
-
- 4e
-
→ 2H
2
O + O
2
Industrijski se dobija :
Krekovanjem ugljovodonika :
C
2
H
6
→ C
2
H
4
+ H
2
Redukcijom vodene pare sa ugljenikom:
C + H
2
O → CO + H
2
JEDINJENJA :
Gradi jedinjenja sa negativnim stepenom oksidacije.Ona jedinjenja u kojima vodonik ima stepen
oksidacije -1 nazivaju se hidridi, a mogu se podjeliti:
a) Hidirde sonog karaktera koji sadrže H
-
jone uopšteno pokazuju osobine jonskih jedinjenja
(
LiH,NaH
...)
b) Metalne hidide, koje grade d i f elementi
c) Kovalentne polimerizovane hidride koji čine najslabije definisanu i najmanje istraženu
grupu hidrida
Želiš da pročitaš svih 42 strana?
Prijavi se i preuzmi ceo dokument.
Slični dokumenti

Ovaj materijal je namenjen za učenje i pripremu, ne za predaju.