
Nezasićeni ugljovodonici Pregled
ГИМНАЗИЈА „СВЕТОЗАР МАРКОВИЋ“
Јагодина
Незас
и
ћени
угљоводоници
Матурски рад
Кандидат:
Ментор:
Лазар Петровић
IV/
4
Марија Станић
2
Незасићени угљоводоници
Јагодина, Мај 2013.
С А Д Р Ж А Ј
1. УВОД..........................................................................................................................................3
2. ПОДЕЛА УГЉОВОДОНИКА..................................................................................................4
3. ХЕМИСКЕ ОСОБИНЕ НЕЗАСИЋЕНИХ УГЉОВОДОНИКА.............................................5
4.АЛКЕНИ.....................................................................................................................................7
4.1. НОМЕНКЛАТУРА АЛКЕНА ...................................................7
4.2. ДОБИЈАЊЕ................................................................................9
4.3. ФИЗИЧКЕ ОСОБИНЕ .............................................................9
4.4. ХЕМИЈСКЕ ОСОБИНЕ............................................................10
5.АЛКИНИ....................................................................................................................................16
5.1. НОМЕНКЛАТУРА АЛКИНА....................................................16
5.2.ФИЗИЧКЕ ОСОБИНЕ...............................................................17
5.3. ХЕМИЈСКЕ ОСОБИНЕ............................................................18
6.АЛЕНИ.......................................................................................................................................20
7. ДИЕНИ.....................................................................................................................................20.
7.1. ОПШТЕ ОСОБИНЕ ДИЕНА (АЛКАДИЕНА)..........................20
7.2. КОЊУГАЦИЈА ВЕЗА.................................................................21
7.3. РЕАКЦИЈЕ ДИЕНА....................................................................21
ЗАКЉУЧАК..................................................................................................................................22
ЛИТЕРАТУРА..............................................................................................................................22

4
Незасићени угљоводоници
2. ПОДЕЛА УГЉОВОДОНИКА
Према скелету, угљоводоници се дијеле на ацикличне (отворен скелет, има главу и
реп) и цикличне (затворен скелет, нема ни главе ни репа).
Према врсти везе унутар скелета угљоводоници се дијеле на засићене и незасићене:
Засићени угљоводоници су они код којих се између атома угљеника јављају само
једноструке хемијске везе (нема двоструких нити троструких веза)
Незасићени угљоводоници су они код којих се између атома угљеника јављају не
само једноструке, већ и двоструке и/или троструке хемијске везе.
Према распореду угљеникових атома, угљоводоници могу бити:
ациклични – имају линијски (разгранати или не) распоред угљеникових атома
циклични – имају циклични распоред угљеникових атома
Према томе, постоје 4 веће групе угљоводоника:
засићени, ациклични (парафински угљоводоници):
алкани
незасићени, ациклични (олефински угљоводоници):
алкени
– са једном двоструком везом
алкини
- са једном троструком везом
алени
Полиени ( диени, триени, тетраени...) – са више (2, 3, 4...) двоструких веза
5
Незасићени угљоводоници
засићени, циклични (нафтенски угљоводоници):
циклоалкани
незасићени, циклични (ароматични угљоводоници):
арени
3. ХЕМИЈСКЕ ОСОБИНЕ НЕЗАСИЋЕНИХ УГЉОВОДОНИКА
Незасићени угљоводоници су знатно реактивнији. Као и засићени они горе, али за
разлику од њих подложни су и утицају слабих оксидационих средстава. Тако благом
оксидсацијом
алкена настају једињења са две алкохолне групе.
блага оксидација алкена
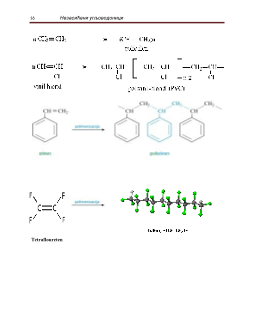
Најтипичинија реакција за незасићена једињења је адиција.
Адицијом
незасићена
једињења теже прелазе у стабилна, засићена једињења. Адиција незасићених
угљоводоника најлакше се изводи помоћу халогена. За адицију водоником потребни су
катализатори (платина или паладијум).По правилу адира се прво угљеников атом који је
најсиромашнији водоником (што се тумачи електронскм утицајима).
7
Незасићени угљоводоници
4. АЛКЕНИ
Алкени
су органска једињења из групе незасићених угљоводоника код којих се
јавља најмање једна двострука хемијска веза између атома угљеника (C=C). Алкени као и
алкани граде хомологи ред чији се сусједни чланови разликују за поједну CH
2
групу.
Сваки атом угљеника повезан је са два атома водоника, а угљеникови атоми који граде
двоструку везу међусобно су повезани са два електронска пара. Та двострука веза између
угљеникових атома представља функционалну групу алкена.
Најједноставнији алкен има формулу C
2
H
4
који носи назив етен. Општа формула
алкена је C
n
H
2n.
Алкени који садрже две двоструке везе називају се диени. Алкени са више од две
двоструке везе (триени, тетраени итд.) се уопштено називају полиени.
4.1. Номенклатура алкена
По IUPAC-овој номенклатури имена алкена се изводе из имена одговарајућих
алкана са истим бројем угљеникових атома, тако што се одбија наставак –ан и на његово
место додаје наставак –ен. Положај двоструке везе се означава бројем првог угљениковог
атома за кога је везана двострука веза. Нумерисање атома угљеника се врши бројевима
тако да су угљеникови атоми на којима се јавља двострука веза обележени најмањим
Želiš da pročitaš svih 24 strana?
Prijavi se i preuzmi ceo dokument.
Slični dokumenti

Ovaj materijal je namenjen za učenje i pripremu, ne za predaju.


























































