
Oksidacioni broj Pregled
ОСНОВНЕ АКАДЕМСКЕ СТУДИЈЕ
Предмет: Хемијски параметри радне и животне средине
СЕМИНАРСКИ РАД
Тема: Оксидациони број
Ментор:
Студенти:
др. Ђорђевић Амелија
Страхиновић Душан 11020
Ђорђевић Александар 11017
Ниш, 2013.
2
Садржај:
Увод ............................................................................................................................................................. 3
1. Оксидациони број ..
............................................................................................................................ 4
2. Правила за одређивање оксидационог броја .........................................................................
5
3. Валенца и оксидациони број ............................................................................................
....... 6
4. Степен оксидације
.............................................................................................................................. 7
Закључак ......................................................................................................................................16
Литература................................................................................................................................... 17
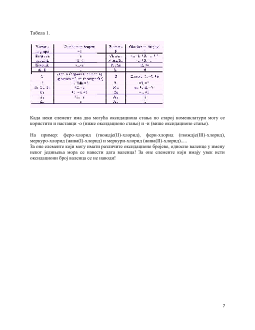
4
1. Оксидациони број
Оксидациони број у хемији представља број електрона, које је дати атом предао или
примио од других атома док је градио хемијско једињење. Термин "предаја" или
"примање" електрона у овом случају може да означава потпуну предају електрона другом
атому (или групе њих), што доводи до јонске везе, или само делимичну предају електрона,
што доводи до поларне ковалентне везе. Ово практично значи да оксидациони број, у
ствари, представља број електрона које би атом примио или отпустио када би све везе које
је наградио биле јонске.
Оксидациони број се рачуна као баланс свих предатих и примљених електрона у датом
атому. Према томе, оксидациони број може бити позитиван (уколико атом отпушта
електроне) или негативан (уколико атом прима електроне), као и да има вредност нула
(уколико се налази у елементарном стању или су све везе које гради неполарне).
Оксидациони бројеви су углавном цели бројеви (мада постоје и једињења у којима
поједини елементи за вредности оксидационих бројева немају целобројне вредности).
Дефиниција по
IUPAC гласи:
Оксидациони број (Мера степена оксидације атома у
супстанци), дефинише се као наелектрисање које би атом имао када би се електрони
рачунали према утврђеном скупу правила:
1. оксидациони број слободног елемента (несједињеног елемента) је нула,
2. за једноставан (моноатомски) јон, оксидациони број је једнак наелектрисању тог
јона,
3. водоник има оксидациони број 1 и кисеоник има оксидациони број -2 у већини
једињења. (Изузеци од овога су кад водоник има оксидациони број -1 у хидридима
метала, нпр. LiH, а кисеоник има оксидациони број -1 у пероксидима, нпр. H
2
O
2
,
4. алгебарски збир оксидационих бројева свих атома у неутралном молекулу мора
бити нула, док у јонима алгебарски збир атома мора бити једнак наелектрисању
јона. На пример, оксидациони бројеви сумпора у H
2
S, S
8
(елементарни сумпор),
SO
2
, SO
3
, и H
2
SO
4
су, респективно, -2, 0, +4, +6 и +6. Што је већи оксидациони број
датог атома, већи је његов степен оксидације; што је мањи оксидациони број, већи
је његов степен редукције.
Оксидациони број не треба мешати са валенцом. На пример, у једињењу H
2
O
2
кисеоник је
двовалентан (сваки атом кисеоника гради по две ковалентне везе), али оксидациони број
кисеоника је -1 (јер је једна од тих ковалентних веза између два атома кисеоника, што је
чини неполарном).
У називима хемијских једињења, кад елемент може имати више вредности оксидационог
броја, оксидациони број се пише римским цифрама у загради, нпр. сумпор(IV)-оксид.
Želiš da pročitaš svih 14 strana?
Prijavi se i preuzmi ceo dokument.
Slični dokumenti

Ovaj materijal je namenjen za učenje i pripremu, ne za predaju.


























































