
Radiohemija Pregled
Univerzitet u Mostaru „Džemal Bijedić“
Nastavnički fakultet-Hemija
SEMINARSKI RAD
Predmet: RADIOHEMIJA
Seminarski rad-Radiohemija
2
SADRŽAJ
1. UVOD
........................................................................................................................3
2. STRUKTURA ATOMA
.........................................................................................4
2.1. Struktura atoma.....................................................................................................4
2.2. Historija.................................................................................................................4
2.3. Atomski i maseni broj............................................................................................6
2.4. Izotopi i upotreba izotopa......................................................................................7
2.5. Nuklearna fuzija i nuklearna fisija.........................................................................9
2.6. Atomska zračenja.................................................................................................10
3
.
RADIOAKTIVNOST..
............................................................................................11
3.1. Radioaktivi raspad................................................................................................13
3.2. Zakon radioaktivnog raspada................................................................................15
3.3. Djelovanje radioaktivnog zračenja........................................................................16
3.4. Mjerenje jedinice radioaktivnosti..........................................................................17
3.5. Ekvivalent doza ili dozni ekvivalent.....................................................................19
3.6. Faktori kvalitete Q................................................................................................20
4. VRSTE RADIOAKTIVNIH RASPADA
.............................................................20
4.1. Alfa- raspad..........................................................................................................21
4.2. Alfa- zračenje.......................................................................................................22
4.3. Beta- raspad.........................................................................................................23
4.4. Beta- zračenje......................................................................................................24
4.5. Gama- raspad.......................................................................................................25
4.6.Gama- zračenje (unutarnja konverzija).................................................................26
5. ZRAČENJE (RADIJACIJA)
.................................................................................27
5.1. Izvori zračenja i njihova primjena........................................................................29
5.2. Prirodni i umjetni radionuklidi ............................................................................30
5.2.1. Prirodna radioaktivnost.....................................................................................30
5.2.2. Proizvedena (umjetna) radioaktivnost...............................................................32
6. MJERENJE JONIZUJUĆEG ZRAČENJA
.........................................................33
6.1. Jonizacijski detektori i radioaktivni gromobrani...................................................34
6.2. Scintilacijski detektori..........................................................................................36
6.3. Poluvodički detektori............................................................................................37
7. ZRAČENJE NAMIRNICA
.....................................................................................38
7.1. Elektromagnetni spektar i podjela zračenja...........................................................38
7.2. Ultraljubičasto zračenje..........................................................................................39
7.3. Jonizujuće zračenje.................................................................................................39
7.4. Efekti zračenja namirnica.......................................................................................40
7.5. Hemijske promjene u ozračenim namirnicama......................................................41
7.6. Promjene u hranjivoj vrijednosti ozračene namirnice...........................................42
8. LITERATURA
.........................................................................................................43

Seminarski rad-Radiohemija
4
2. STRUKTURA ATOMA
2.1. STRUKTURA ATOMA
Riječ
atom
dolazi od starogrčke riječi
atomos
- nedjeljiv, što je u skladu s
vjerovanjem (aktualnim do 19. stoljeća) da su atomi najmanji djeljivi elementi
materije.
Atom
je osnovna gradivna jedinica tvari. Atom se sastoji od jezgre (koju čine
protoni i neutroni) i elektrona koji se nalaze u ljuskama oko jezgre. Jezgra čini 99.98%
mase atoma. Promjer jezgre (10
-15
m) je 100 000 puta manji od promjera atoma (10
-10
m).
Atom
je električki neutralna čestica.Sastoji se od
jezgre
i
elektronskog omotača
.
Jezgra sadrži pozitivno nabijene protone i nenabijene neutrone, a elektronski oblak je
građen od negativno nabijenih elektrona. Elektroni su raspoređeni u ljuskama odnosno
orbitalama. Svojstvo atoma da popuni posljednju (najudaljeniju) orbitalu naziva se
afinitet prema elektronu.
Protoni i neutroni imaju jednaku masu, te su oko 2000 puta su teži od elektrona. Masa
elektrona, masa protona i masa neutrona su fundamentalne konstante, i mogu se pronaći u
tablici periodnog sistema elemenata.
2.2. HISTORIJA
Otkriće elektrona 1897. (Dalton) pokazalo je da se u atomima nalaze još
fundamentalnije čestice. 14 godina kasnije, Rutherford je otkrio da se većina mase atoma
nalazi u sičušnoj jezgri (nucleus) čiji je radijus samo 1/100000 u odnosu na cijeli atom. U
međuvremenu, Max Planck (1858. - 1947.) postavio je teoriju da se svijetlost sastoji od
fotona koji su ekvivalent česticama valnog gibanja.
Po otkricu strukture atoma, mnogi naucnici su pokusali dati model atoma i objasniti
zakonitosti koje vladaju unutar njeg. Sljedeci naucnici su se okusali u tome:
Seminarski rad-Radiohemija
5
1.
Prvi model atoma pripisuje se Demokritu. Pošto u to doba nije bilo nikakvih
saznanja o strukturi atoma (nisu postojali elektronski mikroskopi), atomi su
zamišljani kao jako malene nedjeljive kuglice.
2.
"Puding"-model - kad je otkriven elektron, formirana je teorija da su u središtu
atoma elektroni, a svuda okolo je pozitivan naboj. Metafora je grožđica u pudingu
(grožđice su malene, a zdjelica pudinga velika).
3.
Bohrov model je ustanovljen poslije Rutherfordovih eksperimenata kojima je
utvrđeno da je u centru atoma malena pozitivno nabijena jezgra (nucleus), a elektroni
kruže u orbitale oko jezgre poput planeta koji kruže oko Sunca. No, da bi model bio
prihvaćen, trebalo je riješiti sljedeći problem: Jezgra je pozitivno nabijena, elektron
negativno, zašto elektron uopće kruži oko jezgre, zašto se ne spoji s jezgrom?
Rješenje je prodložio 1913. godne Niels Bohr sa slijedeće 4 pretpostavke:
Seminarski rad-Radiohemija
7
Atomski broj treba razlikovati od masenog broja koji predstavlja zbir broja protona i
neutrona u atomskom jezgru.
Maseni broj je zbir broja protona i neutrona u jezgri atoma. Označava se
superskriptom ispred simbola elementa (dok se atomski broj označava subskriptom) npr.:
U ovom primjeru je atomski broj 6 (što znači da u jezgri ima 6 protona), a maseni broj 12
(što znači da je prisutno i 6 neutrona).
Za atom:
atomski broj je 6 (u jezgri se nalazi 6 protona), a maseni broj je 13 (prisutno je 7
neutrona). Ovo su primjeri izotopa (atoma sa istim atomskim, a različitim masenim
brojevima).
2.4. IZOTOPI I UPOTREBA IZOTOPA
Izotopi
su atomi hemijskog elementa čije jezgro ima isti atomski broj,
Z
, ali različitu
A
. Reč izotop, znači na istom mestu, i dolazi od činjenice da se izotopi
nalaze na istom mestu u periodnom sistemu elemenata.
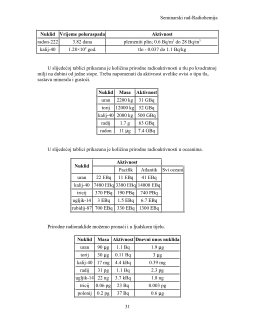
Želiš da pročitaš svih 44 strana?
Prijavi se i preuzmi ceo dokument.
Slični dokumenti

Ovaj materijal je namenjen za učenje i pripremu, ne za predaju.


























































