
Termodinamika Pregled
!!
@eqko Ciganovi}
!
!
TERMODINAMIKA
KRATKI IZVODI IZ TEORIJE
!
JUL 2003.
!
termodinamika - kratki izvodi iz teorije
str. 2
!
UVOD
!
Zatvoren termodinami~ki sistem je deo op{teg prostora (okoline), odvojen od okoline granicom
sistema. U zatvorenom termodinami~kom sistemu nalazi se radno telo. Masa radnog tela u
zatvorenom termodinami~kom sistemu tokom termodinami~kih procesa je konstantna. Granica
zatvorenog termodinami~kog sistema je zatvorena (ne propusna) za masu.
granica
sistema
radno telo
Radno telo u zatvorenom termodinami~kom sistemu ima svoje veli~ine stawa, i to:
-
mehani~ke:
2/!
pritisak
-!q!!
!
!
!
!
!)Qb*!
!
3/!
temperatura
-!U!
!
!
!
!
)L*!!
4/!
specifi~na zapremina
-!w! !
!
!
)
lh
4
n
*!
!
-
toplotne
;! !
2/!
specifi~na unutra{wa energija
-!v! !
!
)
lh
lK
*!
3/!
specifi~na entalpija
-!i!
!
!
!
)
lh
lK
*!
4/!
specifi~na entropija
-!t!
!
!
!
)
lhL
lK
*!
!
Do promena veli~ina stawa (mehani~kih i/il toplotnih) dolazi usled spoqnih energetskih uticaja
na radno telo. Postoje dve vrste spoqnih energetskih uticaja:
!
2/!
mehani~ki spoqni uticaj
!
!
(mehani~ki rad)
x
23
!
)
lh
lK
*!
!
3/!
toplotni spoqni uticaj
(koli~ina toplote)
!
r
23
!
)
lh
lK
*!
@eqko Ciganovi}
tel. 011/53
−
37
−
416

termodinamika - kratki izvodi iz teorije
str. 4
Termodinami~ki proces je matemati~ki zakon po kojem radno telo mewa svoje termodinami~ko
stawe (veli~ine stawa) od po~etnog stawa (1) do krajwog stawa (2). Ako matemati~ki zakon po kojem
radno telo mewa svoje termodinami~ko stawe od po~etnog stawa (1) do krajwog stawa (2) va`i i u
svim me|u ta~kama putawe takva promena stawa je kvazistati~ka. Ako matemati~ki zakon po kojem
radno telo mewa svoje termodinami~ko stawe od po~etnog stawa (1) do krajwog stawa (2) va`i samo u
po~etnoj i krajwoj ta~ki putawe takva promena stawa je nekvazistati~ka.
!
adijabatsko
prigu{ivawe
)i>jefn*!
!
razni drugi
procesi
!
!
politropske
q!
/
!w
n
!>!jefn!
!
politropske
q!
/
!w
o
!>!dpotu!
!
nekvazistati~ke (neravnote`ne)
kvazistati~ke (ravnote`ne)
promene stawa idealnog gasa
!
!
Termodinami~ki dogovor o znacima (+/
−
) za spoqne uticaje:
!
radno telo
r
23
=!1!
r
23
!?!1!
!
Kada se u termodinami~kom procesu radnom telu dovodi toplota onda je ona pozitivna
!)r
23
?1
), a
kada se u termodinami~kom procesu od radnog tela odvodi onda ona je negativna
!)r
23
!=!1*/!
Ako se
druga~ije u tekstu zadatka ne ka`e smatra se da svaki proces razmene toplote izme|u radnog tela i
uzroka razmene toplote traje do uspostavqawa toplotne ravnote`e izme|u radnog tela i uzroka
razmene toplote ( do izjedna~avawa temperatura). Ovakav slu~aj zove se najpovoqniji
termodinami~ki slu~aj.
napomena: Znak
(+/
−
) za
r
23
i
∆
t
23
!
je uvek isti.
!!
radno telo
x
23
?!1!
x
23
!=!1!
!
Kada se u termodinami~kom procesu radnom telu dovodi rad onda je on negativan
!)x
23
!=!1*
, a kada se
u termodinami~kom procesu od radnog tela odvodi rad onda je on pozitivan
)x
23
?1*/!
Ako se
druga~ije u tekstu zadatka ne ka`e smatra se da svaki proces razmene rada izme|u radnog tela i
uzroka razmene rada (spoqa{wa mehani~ka sila) traje do uspostavqawa mehani~ke ravnote`e
izme|u radnog tela i uzroka razmene rada ( do izjedna~avawa pritisaka).
!
napomena: Znak
(+/
−
) za
x
23
i
∆
w
23
!
je uvek isti.
@eqko Ciganovi}
tel. 011/53
−
37
−
416
termodinamika - kratki izvodi iz teorije
str. 5
!
2/!
Prvi zakon termodinamike
: (za proces u zatvorenom termodinami~kom sistemu)
!
!
Prvi zakon termodinamike pokazuje me|usobnu zavisnost izme|u spoqnih uticaja
!)R
23
i
!X
23
) koji
izazivaju posmatrani termodinami~ki proces i promene unutra{we energije radnog tela
!)
∆
V
23
*/!!
23
23
23
X
V
R
+
∆
=
!
!
3/!
Drugi zakon termodinamike
: (za proces u zatvorenom termodinami~kom sistemu)
!
!
Drugi zakon termodinamike govori o karakteru termodidnami~kog procesa (povratan ili
nepovratan). Ra~unski se predstavqa izra~unavawem promene entropije termodinami~kog sistema.
!
VSU
SU
tjtufn
T
T
T
∆
+
∆
=
∆
!
∆
T
tjtufn
!!
−
!
promena entropije izolovanog termodinami~kog sistema
!
)
L
lK
*!
∆
T
SU
!
!
−
!
promena entropije radnog tela
!
!
!
!
)
L
lK
*!
!
!
!
)!
na~in izra~unavawa zavisi od radnog tela )
!
∆
T
VSU
! !
−
!
promena entropije uzroka razmene toplote
! !
!
)
L
lK
*!
!
!
)!
izra~unava se iz jedna~ine
!
∆
T
VSU
!>
VSU
23
U
R
−
!*!
!
Diskusija rezultata za
!
∆
T
tjtufn
;!
!
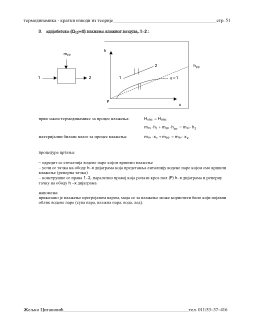
2/!
∆
T
tjtufn
!>!1!
Ovakvi termodinami~ki procesi zovu se povratni (reverzibilni). Ovoj grupi
pripadaju samo dva procesa:
!
−
kvazistati~ka adijabata
−
kvazistati~ka izoterma, pri ~emu je temperatura radnog tela jednaka temperaturi uzroka
razmene toplote
!
Uslovono gledano i svaki drugi proces bi mogao da bude povratan uz jedan od uslova:
1.1. dovo|ewe toplote se vr{i uz prisustvo beskona~no mnogo toplotnih izvora tj odvo|ewe toplote
se vr{i uz prisustvo beskona~no mnogo toplotnih ponora ~ije temperature su jednake temperaturi
radnog tela u svakom trenutku procesa (stepenasta promena stawa)
1.2. dovo|ewe toplote se vr{i od toplotnog izvora ~ija promena temperature odgovara promeni
temperature radnog tela tj. po~etna temperatura radnog tela jednaka je krajwoj temperaturi
toplotnog izvora i obrnuto krajwa temperatura radnog tela jednaka je po~etnoj temperaturi
toplotnog izvora (sli~no va`i i za predaju toplote radnog tela toplotnom ponoru)
U!
U
t!
qspdft!tb!sbeojn!ufmpn!
!
qspdft!tb!upqmpuojn!j{wpspn!
3!
U
Ujo!
U
Uj2!
2!
t!
!
3/!
∆
T
tjtufn
!?!1!
Ovakvi termodinami~ki procesi zovu se nepovratni (ireverzibilni)
@eqko Ciganovi}
tel. 011/53
−
37
−
416
termodinamika - kratki izvodi iz teorije
str. 7
1. IDEALAN GAS
!
Mehani~ke veli~ine stawa mogu se odrediti na dva na~ina.
1. jedna~ine stawa idealnog gasa:
!!
!
U
S
>
w
q
h
⋅
⋅
!
!
( za
!2!lh!
idealnog gasa)
U
S
n
W
q
h
⋅
⋅
=
⋅
!
( za
!n!lh!
idealnog gasa)
( )
U
NS
o
W
q
⋅
⋅
=
⋅
!
( za
!o!lnpm
idealnog gasa)
(koristi se onda kada su poznate dve veli~ine stawa, a potrebno je odrediti tre}u.)
!
!
!
S
h
!
−
!
gasna konstanta
-!
lhL
K
!
!
!
)
priru~nik str.23
*!!
ili
!S
h
>
( )
N
NS
!
!
N!!
−
!
molska masa gasa
!! !
lnpm
lh
! !
!
)
priru~nik str.23
*!
!
>S
(
NS
)
v
!>!S!>!9/426!
lnpmL
lK
!>!9426!
lnpmL
K
-!!
univerzalna gasna konstanta konstanta,
!
!
2. kombinacijom jedna~ine stawa idealnog gasa i zakona promene stawa (dve jedna~ine sa dve
nepoznate). koristi se onda kada je poznata jedna veli~ina stawa (druge dve nisu) i zakon po kojem se
vr{i promena stawa.
Za kvazistati~ke politropske promene stawa
(
)
dpotu
w
q
o
=
⋅
re{ewe prethodnog sistema dve
jedna~ine sa dve nepoznate nalazi se u priru~niku za termodinamiku str. 118).
Toplotne veli~ine stawa:
!
Mada nije uobi~ajeno za prakti~ne potrebe toplotne veli~ine stawa idealnog gasa se mogu
definisati na slede}i na~in:
U
d
v
w
⋅
=
specifi~na unutra{wa energija
!
)
lh
lK
*
U
d
i
q
⋅
=
specifi~na entalpija
-!!
!
)
lh
lK
*!
s
U
U
mo
l
t
⋅
=
specifi~na entropija
-!!
!
)
lhL
lK
*!
!
d
q
!-!)d
w
*!
−
!
toplotni kapacitet (specifi~na toplota) pri stalnom pritisku (zapremini)
!
)
lhL
lK
*!!
!
Toplotni kapacitet pri stalnom pritisku
!)d
q
*
i toplotni kapacitet pri stalnoj zapremini
!)d
w
*
su u
me|usobnoj vezi sa gasnom konstantom
!)S
h
*!
preko Majerove jedna~ine
;! !
S
h
!>!d
q
!
−
!d
w!
Tabelarni prikaz ovih konstanti
!)S
h
-!d
q
-!d
w*
!
dat je u priru~niku na str
/34!!)
tabela
!4/5*!!
!
@eqko Ciganovi}
tel. 011/53
−
37
−
416
Želiš da pročitaš svih 73 strana?
Prijavi se i preuzmi ceo dokument.
Slični dokumenti

Ovaj materijal je namenjen za učenje i pripremu, ne za predaju.


























































