
Termodinamika Pregled
0. OSNOVNE DEFINICIJE
Termodinamicki sistem
je deo opsteg prostora odvojen od okoline granicom sistema. Ako
kroz granice sistema ne dolazi do toplotnih interakcija sistema i okoline takav sistem zave se
izolovan sistem a ako kroz granice sistema dolazi do toplotnih interakcija sistema i okoline takav
sistem zave se neizolovan sistem
Izolovan termodinamicki sistem
sacinjavaju:
- radno telo (radna materija)
-
toplotni
rezervoar (toplotni izvor ili toplotni ponor)
Kod izolovanih termodinamickih sistema do promena velicina stanja radnog tela dolazi usled
medjusobnih interakcija :
1. radnog tela i toplotnih rezervoara,
2. radnog tela i spoljnjih mehanickih sila
3. medjusobnih interakcija dva razlicita radna tela (adijabatsko mesanje, razmenjivaci
toplote itd.)
Pri tom radno telo menja svoje mehanicke velicine stanja (pritisak, specificna zapremina, i apsolutna
temperatura) i toplotne velicine stanja (entalpija, unutrasnja energija, entropija) na racun razmenjene
toplote ili rada.
Neizolovan termodinamicki sistem
sacinjavaju:
- radno telo (radna materija)
-
toplotni
rezervoar (toplotni izvor ili toplotni ponor)
-
okolina
Kod ne izolovanih termodinamickih sistema do promena velicina stanja radnog tela dolazi usled
medjusobnih interakcija :
1. radnog tela i okoline,
2. radnog tela, okoline i toplotnih rezervoara
3. medjusobnih interakcija dva razlicita radna tela (adijabatsko mesanje, razmenjivaci
toplote itd.)
i okoline
Toplotni rezervoari su neizolovani termodinamicki sistemi koji sa radnim telom u tokou
nekog procesa razmenjuju toplotu. Toplotni izvori radnom telu daju toplotu a toplotni pomori od
radnog tela primaju toplotu. Zajednicke osobine toplotnih izvora i ponora su da imaju konstantnu
temperaturu (T=const)
Kod neizolovanih termodinamickih sistema ulogu toplotnih rezervoara najcesce preuzima
okolina.
Nas zadatak je da odredjujemo velicine stanja radnog tela (mehanicke i toplotne) i spoljne
uticaje (toplota i rad). Nacini odredjivanja velicina stanja radnog tela zavise od samog radnog tela (da
li je idealno, poluidealno ili realno). Na ovom kursu upoznacemo se sa nekoliko radnih tela:
1. idealan gas
1
2. vodena para (realan gas)
3. vlazan vazduh (realan gas)
Za svako od ovih radnih tela postoje razliciti matematicki modeli za odredjivanje velicina
stanja (jednacine, tablice, dijagrami).
2

R
g
= c
p
- c
v
4
Vrednost ovih konstanti (c
p
, c
v
i
κ
) nalazi se na str 110, kao u sledecoj tabeli:
c
V
c
P
κ
Jednoatomni gas
g
R
2
3
g
R
2
5
3
5
Dvoatomni gas
g
R
2
5
g
R
2
7
5
7
Tr(vise) atomni gas
g
R
2
7
g
R
2
9
7
9
Spoljni uticaji na radno telo u zatvorenom termodimnamickom sistemu su
:
kolicina toplote, q
12
[J/kg],
(uticaj
toplotnih
interakcija)
12
s
s
q = T(s)ds
1
2
∫
,
apsolutni (zapreminski) rad l (J/kg),
(uticaj
spoljasnjih
mehanickih sila)
p(v)dv
=
W
v
v
2
1
∫
12
Ako je podintegralan funkcija linearna resavanje integrala oblika
svodi se na
primeu trapezne formule:
I =
f x dx
x
x
( )
1
2
∫
I =
x - x
2
[f( x )+ f( x )]
2
1
2
1
,
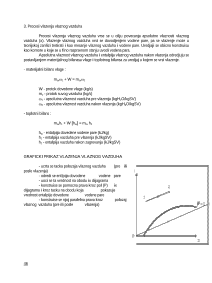
Graficka interpretacija resenje integrala predstavljaja povrsinu ispod odgovarajucih krivih
na Ts (toplota) i pv dijagramu (zapreminski ili tehnicki rad)
W
12
Q
12
5
Termodinamicki dogovor o znacima za spoljne uticaje (kolicinu toplote i rad)
Q
12
> 0
u termodinamickom sistemu pored radnog tela postoji toplotni izvor
Q
12
< 0
u termodinamickom sistemu pored radnog tela postoji toplotni ponor
W
12
< 0
kompresija radnog tela
W
12
> 0
ekspanzija radnog tela
Kvazistaticke politropske promene stanja idealnih gasova
Sve promene stanja ovog tipa pokoravaju se jednom od zakona (u zavisnosti od odabranog
koordinatnog sistema) :
pv
n
= const
(u pv koordinatama)
Tv
n-1
= const
(u Tv koordinatama)
T
n
p
1-n
= const
(u Tp koordinatama)
Sve ove promene stanja predstavljamo graficki pomocu jednacina p=f(v) u pv dijagramu (dijagram
rada) i T=f(s) u Ts dijagramu (dijagram toplote). Ove jednacine se zovu zakoni promena. Sve te
jednacine razlikuju se samo po eksponentu politropske promene u opstim politropskim jednacina za
kvazistaticke promene stanja:
p=const (n=0)
izobara
T=const (n=1)
izoterma
v=const (n=
∞
)
izohora
s=const (n=
κ
)
povratna izentropa (povratna adijabata)
Neke od navedeni kvazistatickih promene stanja generisu prirastaj promene entropije sistema a neke
ne. One promene kod kojih nema promene entropije sistema (
Δ
S
si
=0) nazivaju se povratne promene.
Takve promene su:
- povratna izentropa (povratna adijabata)
- izoterma (kada se razmena toplote vrsi na temperaturi okoline)
One promene koje generisu promenu entropije sistema (
Δ
S
si
>0) nazivaju se nepovratne promene.
Takve promene su:
-
izohora
Q
12
> 0
Q
12
< 0
radno telo
W
12
< 0
W
12
> 0
radno telo
7
Želiš da pročitaš svih 65 strana?
Prijavi se i preuzmi ceo dokument.
Slični dokumenti

Ovaj materijal je namenjen za učenje i pripremu, ne za predaju.


























































