
Eksperimentalna fizička hemija Pregled
Dr Mirjana Medenica
Dr Du{an Male{ev
Eksperimentalna
W
zi~ka hemija
Beograd, 2002.
EKSPERIMENTALNA FIZI^KA HEMIJA
Dr Mirjana Medenica, red. prof.
Dr Du{an Male{ev, red. prof.
Drugo izdanje
Recenzenti
Dr Dragan Veselinovi}, red. prof. u penziji
Fakultet za fizi~ku hemiju u Beogradu
Dr Zorica Radovi}, red. prof.
Farmaceutski fakultet u Beogradu
Odlukom dekana Farmaceutskog fakulteta u Beogradu broj 1527/2-BJR od 21. 09. 1998.
ova knjiga odobrena je kao univerzitetski ud`benik.
Izdava~
Dr Mirjana Medenica
Lektor
Mr Pejo Vukeli}
Fotografije
Branislav Nikoli}
Grafi~ko oblikovanje
Ilija Kne`evi}
Korice
Dr Mirjana Medenica
Tira` 1500
[tampa
Akademija {tamparija
, Narodnog fronta 43, Beograd
Sva prava zadr`ana. Nijedan deo ove knjige ne mo`e biti reprodukovan u bilo kom obliku
ili smislu bez pismenog odobrenja izdava~a i/ili autora.
ISBN 86-901485-4-X
Ud`benik
Eksperimentalna fizi~ka hemija
nastao je kao rezultat du-
gogodi{njeg rada sa studentima u laboratoriji Zavoda za fizi~ku he-
miju Farmaceutskog fakulteta Univerziteta u Beogradu. Prvenstveno
je namenjen studentima Farmaceutskog fakulteta za predmet
Fizi~ka
hemija i instrumentalne metode
.
Ud`benik sadr`i 11 tematskih poglavlja predvi|enih planom i
programom studija na Farmaceutskom fakultetu u Beogradu. Svako
teorijsko poglavlje (
Teorijski princip
) pra}eno je i odgovaraju}im
eksperimentima (
Uradite samostalno...
). Pristup svim eksperimen-
tima je isti, {to podrazumeva (
Zadatak ve`be
), neophodnu aparatu-
ru i hemikalije, opis pripreme eksperimenta
(Priprema
), neposred-
nu realizaciju eksperimenta uz detaljan opis aparature (
Postupak
) i
prikaz i obradu dobijenih rezultata merenja (
Rezultati
). Predvi|eno
je da student upisuje rezultate u odgovaraju}e tabele. Na kraju teksta,
u Prilogu knjige, date su tablice fizi~kohemijskih veli~ina i Statisti~ka
obrada rezultata.
Autori se zahvaljuju recenzentima prof. dr Draganu Veselinovi}u
i prof. dr Zorici Radovi} na veoma studioznom ~itanju rukopisa knji-
ge i korisnim savetima koje su doprinele pobolj{anju kvaliteta ruko-
pisa.
Branislav Nikoli} je svojim visoko profesionalnim fotografijama
doprineo kvalitetnoj ilustraciji instrumenata sa kojima se studenti
sre}u u laboratoriji.
Ilija Kne`evi} je svojim prefinjenim umetni~kim izrazom dopri-
neo grafi~kom oblikovanju ove knjige.
Zahvaljujemo se sponzorima koji su omogu}ili {tampanje drugog
izdanja ovog ud`benika.
Autori }e sa zahvalno{}u prihvatiti sve kriti~ke primedbe i suge-
stije ~italaca radi pobolj{anja kvaliteta ovog ud`benika u slede}im
izdanjima.
Beograd, 2002.
Autori
1
. Osobine rastvora
VISKOZNOST /3/
– Odre|ivanje viskoznosti metodom po Ostvaldu (12)
POVR[INSKI NAPON /15/
– Odre|ivanje povr{inskog napona te~nosti stalagmometrom (21)
2.
Koligativne osobine rastvora
KRIOSKOPIJA /27/
– Odre|ivanje molarne mase (32)
3.
Termi~ke osobine rastvora
KALORIMETRIJA /39/
– Odre|ivanje toplote rastvaranja (44)
4.
Osobine molekula
REFRAKTOMETRIJA /49/
– Odre|ivanje molarne refrakcije rastvora (55)
POLARIMETRIJA /61/
– Odre|ivanje koncentracije rastvora saharoze (69)
5.
Apsorpciona fotometrija
KOLORIMETRIJA /75/
– Odre|ivanje koncentracije obojenog rastvora (81)
FOTOMETRIJA /85/
– Odre|ivanje koncentracije obojenog rastvora (89)
SPEKTROFOTOMETRIJA /93/
– Odre|ivanje koncentracije rastvora metodom
kalibracione krive (100)
6.
Elektroliza
ELEKTROLIZA /109/
– Provera Faradejevog zakona (113)
KULOMETRIJSKA TITRACIJA /115/
– Odre|ivanje koncentracije natrijum-tiosulfata (119)
SADR@AJ
1
25
37
47
73
107
Prilog
TABLICE /267/
STATISTI^KA OBRADA REZULTATA /277)
Literatura
Indeks
265
285
289
(1)
Osobine
rastvora
VISKOZNOST
Odre|ivanje viskoznosti
metodom po Ostvaldu
POVR[INSKI NAPON
Odre|ivanje povr{inskog napona te~nosti
stalagmometrom

Tako se Njutnova jedna~ina (1) mo`e jednostavnije prikazati:
Ako su povr{ina A i gradijent brzine V jedini~ne vrednosti, sledi
da je:
{to zna~i da je koeficijent viskoznosti ili, kra}e, viskoznost jedna-
ka sili unutra{njeg trenja. Ova viskoznost naziva se
apsolutna
ili
di-
nami~ka viskoznost
.
Jedinice dinami~ke viskoznosti izvode se iz Njutnovog zakona:
Paskal-sekund (Pa.s) je izvedena jedinica, a defini{e dinami~ku
viskoznost homogenog fluida koji laminarno struji i u kome, izme-
|u dva paralelna sloja na rastojanju od 1 m i gradijentom brzine od
1 (m/s)/m, nastaje napon smicanja od 1 paskala.
Recipro~na vrednost dinami~ke viskoznosti je
fluiditet
φ
. To je
merilo lako}e kojom te~nost mo`e da te~e.
U tablici 1 date su vrednosti za dinami~ku viskoznost nekih te~-
nosti na 20°C.
Te~nost
η
(Pa s)
Ricinusovo ulje
0,986
Maslinovo ulje
0,084
Sulfatna kiselina
0,025
Salicilna kiselina
2,71×10
-3
Glicerol
1,49×10
-3
Etanol
1,20×10
-3
Voda
1,005×10
-3
Ksilol
0,81×10
-3
Toluol
0,59×10
-3
Benzen
6,52×10
-4
Hloroform
5,80×10
-4
Etar
2,33×10
-4
Medenica / Male{ev
4
T
Ta
ab
blliic
ca
a 1
1..
Dinami~ka viskoznost nekih
te~nosti na 20°C
F =
η
. A . V
(2)
F =
η
(3)
η
(=)
(=)
(=)
(=) N . m
–2
s
(=) Pa . s
F
A . V
m/s
m
N
m
2
.
1
s
N
m
2
.
Pored dinami~ke, definisana je i
kinemati~ka viskoznost
ν
, koja
se ~e{}e koristi:
gde je
ρ
– gustina fluida.
Dinami~ka viskoznost koristi se za definisanje osobina samo ~is-
tih (jednokomponentnih) te~nosti, tzv. »njutnovskih sistema« koji
se pona{aju po Njutnovom zakonu, prikazanom jedna~inom (1).
Ostale te~nosti, tzv. heterogeni disperzni sistemi ne pona{aju se po
ovom zakonu i nazivaju se »nenjutnovskim sistemima«.
Ako se radi o binarnim sistemima, rastvorima, koriste se
relativ-
na
,
specifi~na
,
redukovana
i
unutra{nja viskoznost
.
Relativna viskoznost
(
η
r
) predstavlja koli~nik viskoznosti rast-
vora (
η
) i rastvara~a (
η
0
):
To je mera promene viskoznosti rastvora u odnosu na ~ist rast-
vara~ i zato je uvek ve}a od jedinice. IUPAC* preporu~uje da se ova
veli~ina naziva »viskozitetni koli~nik«.
Specifi~na viskoznost
(
η
sp
) prikazuje prira{taj viskoznosti rast-
vora iznad jedinice, prouzrokovan prisustvom rastvorene materije:
Specifi~na viskoznost zavisi od vrste rastvara~a. Kako i relativna i
specifi~na viskoznost zavise od koncentracije, uveden je pojam
re-
dukovane viskoznosti
(
η
red
) koja predstavlja koli~nik specifi~ne
viskoznosti i koncentracije:
Redukovana viskoznost predstavlja prira{taj specifi~ne visko-
znosti po jedinici koncentracije. Za slu~aj da c
Õ
0 definisan je tzv.
grani~ni broj viskoznosti
ili
unutra{nja viskoznost
[η]
:
Eksperimentalna fizi~ka hemija
5
*International Union of Pure and
Applied Chemistry (
Internacionalna
unija za ~istu i primenjenu hemiju
)
ν
=
h
r
(4)
h
r
=
h
h
0
(5)
h
sp
=
=
h
r
– 1
h
–
h
0
h
0
(6)
h
red
=
h
sp
c
(7)
[h]
=
lim
h
sp
c
(8)
c
Õ
0

gde je:
M – molarna masa
η
– dinami~ka viskoznost
ρ
t
– gustina te~nosti
ρ
p
– gustina pare.
U tablici 2 date su vrednosti reohora za neke atome i atomske
grupe, pa se na osnovu aditivnosti mo`e izra~unati reohor slo`enijih
jedinjenja.
A
TOM
/
ATOMSKA GRUPA
R
EOHOR
C
12,8
H (u C–H)
5,5
H (u C–OH)
10,5
O (etarski)
10,0
Cl
21,3
Br
35,8
CH
2
23,8
COO (kiseline i estri)
36,0
Za farmaciju je poznavanje viskoznosti od velikog zna~aja pri-
likom formulacije farmaceutskih preparata i njihovih oblika za ade-
kvatnu primenu (emulzije, paste, supozitorije ili filmovi za oblagan-
je tableta). Proizvodnja medicinskih i kozmeti~kih krema, pasta i
losiona zahteva dobro poznavanje i reolo{kih osobina, kako bi pre-
parat bio pogodan da se primeni na ko`u. Ta~no definisani reolo{ki
parametri od presudnog su zna~aja prilikom izrade injekcionih hi-
podermijskih rastvora, da bi prilikom primene nesmetano proticali
kroz iglu.
Istiskivanje pasta iz tuba, pakovanje granuliranih preparata i
mnogi drugi postupci u farmaceutskoj industriji zahtevaju dobro
poznavanje zakona reologije.
Prou~avanje viskoznosti, kako pravih rastvora tako i koloidnih
disperznih sistema, pored teorijskog ima i prakti~no zna~enje. Me-
renjem viskoznosti koloidnih rastvora mogu}e je odrediti molarnu
masu koloida i objasniti oblik koloidnih ~estica. Ovo je veoma zna-
~ajno u proizvodnji rastvora za zamenu krvne plazme (npr. dekstra-
Eksperimentalna fizi~ka hemija
7
T
Ta
ab
blliic
ca
a 2
2..
Vrednosti reohora nekih atoma
i atomskih grupa
na). Pored ovoga, poznavanje viskoznosti va`no je i za predvi|anje
procesa apsorpcije leka iz gastrointestinalnog trakta.
Za odre|ivanje viskoznosti
koriste se ure|aji koji su zasnovani
na:
a)
Poazejevom
(Poiseuille)
zakonu
za isticanje te~nosti kroz kapi-
larnu cev –
metoda kapilarne cevi
.
b)
Stoksovom
(Stokes)
zakonu
za brzinu padanja kugle kroz stub
te~nosti –
metoda padanja tela
.
Ako se koeficijent viskoznosti odre|uje merenjem brzine istica-
nja te~nosti pod dejstvom Zemljine te`e (slika 4), onda je pritisak
stuba te~nosti
p
jednak sili
F
1
koja pod uticajem sile zemljine te`e
deluje na povr{inu popre~nog preseka stuba te~nosti
S
:
Kako je:
gde je:
h – visina stuba te~nosti
g – ubrzanje Zemljine te`e
ρ
– gustina te~nosti,
to se iz jedna~ina (12) i (13) dobija izraz za silu
F
1
, koja pod uti-
cajem sile Zemljine te`e vr{i smicanje slojeva:
Te~nost po~inje da isti~e kada se sila trenja
F
(jedna~ina 2), koja
spre~ava kretanje slojeva, izjedna~i sa silom
F
1
, koja pokre}e slojeve:
Medenica / Male{ev
8
Metoda kapilarne cevi
S
Slliik
ka
a 4
4..
Metoda kapilarne cevi
p =
F
1
S
(12)
p = h . g .
ρ
(13)
F
1
= h . g .
ρ
. S
(14)
F = F
1
(15)

Deljenjem jedna~ina (19) i (20) i re{avanjem po
η
x
dobija se iz-
raz iz koga se izra~unava koeficijent viskoznosti:
gde je:
η
x
– koeficijent viskoznosti analizirane te~nosti
η
H
2
O
– koeficijent viskoznosti vode
t
x
– vreme isticanja analizirane te~nosti
t
H
2
O
– vreme isticanja vode
ρ
x
– gustina analizirane te~nosti
ρ
H
2
O
– gustina vode.
Primenjena je kod viskozimetra s kuglom, a zasniva se na Stokso-
vom zakonu:
gde je:
h
– koeficijent viskoznosti te~nosti
F – sila trenja pri kretanju kugle kroz stub te~nosti
r – polupre~nik kugle
v – brzina kretanja kugle (v = l/t, gde je
l
– du`ina stuba te~nosti,
a
t
– vreme padanja kugle).
Kugla pada pod dejstvom Zemljine te`e, a sila koja deluje na
kuglu jednaka je:
gde je:
g – ubrzanje Zemljine te`e
ρ
– gustina kugle
ρ
t
– gustina te~nosti.
Medenica / Male{ev
10
Metoda padanja tela
h
x
=
h
H
2
O
r
x
.
t
x
r
H
2
O
.
t
H
2
O
(21)
F
1
=
r
3
π
. g(
ρ
–
ρ
t
)
4
3
(23)
F =
6
p
.
h
. r . v
(22)
Kada se ove dve sile izjedna~e, kugla se kre}e uniformno kroz
te~nost brzinom
v
. Tada iz jedna~ina (22) i (23) sledi:
Kako su veli~ine u razlomku konstantne, to sledi izraz:
Za odre|ivanje viskoznosti po ovoj metodi koristi se
Heplerov
(Höppler)
viskozimetar
(slika 6).
Cev je napunjena te~no{}u poznate gustine. Kuglica, poznate gu-
stine, pada kroz cev ~iji je pre~nik neznatno ve}i od pre~nika kugli-
ce. Meri se vreme padanja kuglice izme|u ozna~enih linija A i B. Ceo
postupak izvodi se uz termostatiranje. Prethodno je potrebno (u
uputstvu za ure|aj) na}i vrednost konstante
K
za kuglice poznatih
gustina i pre~nika.
Eksperimentalna fizi~ka hemija
11
S
Slliik
ka
a 6
6..
Heplerov viskozimetar
η
=
(
ρ
–
ρ
t
)t
2
r
2
g
9
l
(24)
η
= K(
ρ
–
ρ
t
)t
(25)

Preko gumenog nastavka vodu povu}i iznad gornje oznake na
viskozimetru i pustiti da slobodno proti~e kroz kapilaru. Hrono-
metar uklju~iti kada se menisk poklopi sa oznakom A, a isklju~iti ka-
da se menisk poklopi sa oznakom B na viskozimetru. Vreme isticanja,
izra`eno u sekundama, zapisati sa ta~no{}u hronometra. Merenje
vremena isticanja vode (t
H
2
O
) ponoviti deset puta. Viskozimetar za-
tim isprati sa malo etanola i osu{iti na vakuumu.
Postupak
Kao i kod kalibracije viskozimetra, suvom pipetom odmeriti istu za-
preminu analizirane te~nosti i izvr{iti deset merenja vremena isti-
canja analizirane te~nosti (t
x
) na istoj temperaturi.
Iz eksperimentalno dobijenih srednjih vrednosti vremena istica-
nja i datih vrednosti za gustinu i viskoznost vode (tablica 1 u Pri-
logu) izra~unati koeficijent viskoznosti (
η
x
).
Rezultate prikazati tabelarno.
Eksperimentalna fizi~ka hemija
13
t = ..... °C
V = ..... mL (odmerena zapremina te~nosti u viskozimetru)
t = .......°C
ρ
H
2
O
= ....... kg m
-3
(tabli~na vrednost)
η
H
2
O
= ....... Pa s (tabli~na vrednost)
Medenica / Male{ev
14
T
Ta
ab
be
ella
a 2
2..
Gustina i koeficijent viskoznosti
analizirane teènosti
ρ
(kg m
-3
)
η
(Pa s)
Vreme (s)
voda
analizirana te~nost
T
Ta
ab
be
ella
a 1
1..
Vreme isticanja
REZULTATI
Broj merenja
1
2
3
4
5
6
7
8
9
10
srednja vrednost

Te~nost
σ
(N m
-1
) na 20°C
t.k. (°C)
Voda
0,0728
100
Benzol
0,0289
80,1
Toluol
0,0284
110,6
Hloroform
0,0271
61,0
Aceton
0,0237
56,5
Metanol
0,0226
64,7
Etanol
0,0223
78,15
Etar
0,0170
34,6
Na dodiru dve te~ne faze, koje se ne me{aju ili se delimi~no
me{aju, javlja se tzv.
grani~ni sloj
u kome se nalaze molekuli obe faze,
ali u druga~ijem polo`aju u pore|enju sa molekulima u ~istim faza-
ma. Napon koji se javlja u ovom grani~nom sloju posledica je me-
|udejstva prisutnih molekula, pa se naziva
me|upovr{inski napon
ili
me|ufazni napon
(raniji naziv
dodirni napon
). Ovaj napon je
manji od povr{inskog napona, jer su adhezione sile u grani~nom
sloju izme|u dve te~nosti ve}e od sila koje se javljaju izme|u mo-
lekula te~ne i gasovite faze.
Iz koeficijenta povr{inskog napona mo`e se izra~unati veli~ina
koju je Sugden (Sugden) nazvao
parahor te~nosti P
:
gde je:
M – molarna masa analizirane te~nosti
σ
– koeficijent povr{inskog napona te~nosti
ρ
t
– gustina te~nosti
ρ
p
– gustina pare.
Na ni`im temperaturama gustina pare je mnogo manja od gu-
stine te~nosti, pa se mo`e zanemariti. Izraz za parahor dobija jed-
nostavniji oblik:
Medenica / Male{ev
16
Tablica 1.
Povr{inski napon i ta~ka klju~anja
pojedinih te~nosti
P = M
σ
ρ
t
–
ρ
p
(1)
1
4
P = M
σ
ρ
t
(2)
1
4
Parahor ima dimenzije molarne zapremine pomno`ene sa ~etvr-
tim korenom povr{inskog napona (m
3
mol
-1
N
¼
m
-¼
). To je aditiv-
na i konstitutivna veli~ina, {to zna~i da zavisi od vrste, broja i na~ina
vezivanja atoma u molekulu. Mo`e se izra~unati sabiranjem vred-
nosti parahora atoma i veza u molekulu (tablica 2 u Prilogu).
U farmaceutskim istra`ivanjima odre|ivanje povr{inskog napo-
na je od zna~aja za uspostavljanje veze izme|u povr{inske aktivnosti
leka i njegovog biohemijskog i farmakolo{kog dejstva. Tako|e, mo`e
se odrediti i ~isto}a te~nosti, jer eventualno prisutne ne~isto}e me-
njaju vrednost koeficijenta povr{inskog napona.
Za
odre|ivanje povr{inskog napona
postoje razli~ite metode, u
zavisnosti od ta~nosti koja se `eli posti}i, od koli~ine uzorka sa ko-
jim se raspola`e i od jednostavnosti rada.
Metoda merenja mase kapi podrazumeva odre|ivanje broja kapi
koje isteknu iz odre|ene zapremine i merenja njihove mase. U tu
svrhu koristi se Traubeov (Traube) stalagmometar. To je relativna
metoda, jer se povr{inski napon analizirane te~nosti upore|uje sa
povr{inskim naponom standardnog rastvora. Zato je potrebno pret-
hodno kalibrisati stalagmometar sa standardom (npr. vodom).
Traubeov stalagmometar (slika 2) je staklena cev sa pro{irenjem i
kapilarom na donjem kraju, koja se zavr{ava ravnom povr{inom.
Kap te~nosti koja se obrazuje na donjem delu kapilare (prilikom
slobodnog isticanja te~nosti u obliku kapi) otkida se u trenutku ka-
da njena masa savlada povr{inski napon. Ukoliko je povr{inski na-
pon ve}i bi}e i masa kapi ve}a. To zna~i da }e se iz iste zapremine ob-
razovati manji broj kapi. Masa kapi data je slede}im izrazom:
gde je:
m – masa kapi
V – zapremina te~nosti
ρ
– gustina te~nosti
n – broj kapi u zapremini V.
Eksperimentalna fizi~ka hemija
17
Slika 2.
Traubeov stalagmometar
m =
V .
ρ
n
(3)
Metoda merenja mase kapi

Metoda kapilarne cevi (
kapilarna elevacija
) je najpouzdanija meto-
da za odre|ivanje povr{inskog napona. Zasniva se na merenju visine
podizanja te~nosti u kapilarnoj cevi poznatog pre~nika (slika 3).
U kapilari te~nost koja kvasi zidove suda, stvara pritisak usled
delovanja povr{inskog napona te~nosti, koji je prikazan Laplasovom
(Laplace) jedna~inom:
gde je:
σ
– povr{inski napon te~nosti
r – polupre~nik kapilare.
Usled kapilarnih pojava, odnosno adhezionih sila koje slabe pri-
tisak P
1
dolazi do podizanja te~nosti u kapilari do izvesne visine,
usled pritiska koji vlada u masi te~nosti zbog povr{inskog napona.
Hidrostati~ki pritisak stuba te~nosti koji se stvara u kapilarnoj cevi,
u ta~ki B, jednak je:
gde je:
ρ
– gustina te~nosti
g – ubrzanje Zemljine te`e
h – visina stuba te~nosti u kapilarnoj cevi.
Te~nost u kapilari zaustavi}e se na nekoj visini
h
kada se us-
postavi ravnote`a izme|u pritisaka
P
1
i
P
2
:
iz koje se mo`e, merenjem visine stuba te~nosti
h
iznad nivoa te~-
nosti, izra~unati povr{inski napon te~nosti:
Vrednost
ρ
je poznata veli~ina za analiziranu te~nost na temperaturi
merenja. Vrednost
r
je poznata za datu kapilaru ili se mo`e odrediti
kori{}enjem te~nosti poznatih
σ
i
ρ
.
Eksperimentalna fizi~ka hemija
19
Slika 3.
Kapilarni efekat
P – pritisak usled povr{inskog
napona
h – visina stuba te~nosti u kapilari
izme|u ta~aka A i B
P
1
=
2
σ
r
(8)
ρ
. g . h =
2
σ
r
(10)
σ
=
r .
ρ
. g . h
(11)
P
2
=
ρ
. g . h
(9)
Metoda kapilarne cevi
1
2
Me|upovr{inski napon
(koji se javlja na granici dve te~ne faze koje
se ne me{aju ili se delimi~no me{aju) odre|uje se istim metodama
kao i povr{inski napon. Metodom kapilarne cevi, (slika 4) izvodi se
tako {to se te~nost A manje gustine sipa u pro{ireni deo suda koji se
zavr{ava kapilarom polupre~nika
r
. Kapilara se uranja u te~nost B
ve}e gustine. Pomeranjem suda A gore-dole podesi se da dodirne
povr{ine te~nosti u sudu A i te~nosti u sudu B budu na istom nivou i
izmeri visina stuba te~nosti
h
. Tada se me|upovr{inski napon izra-
~unava iz jedna~ine (11) i poznate vrednosti gustine
ρ
A
za te~nost A.
Medenica / Male{ev
20
Slika 4.
Odre|ivanje me|upovr{inskog napona
A – sud sa te~no{}u manje gustine
B – sud sa te~no{}u ve}e gustine
h – visina stuba te~nosti

oznake stalagmometra i stegnuti {tipaljku da te~nost ne isti~e. Kali-
braciju stalagmometra uraditi sa destilovanom vodom prema pos-
tupku datom za odre|ivanje zapremine jedne kapi i za odre|ivanje
broja kapi u pro{irenom delu stalagmometra.
b) Odre|ivanje zapremine jedne kapi
Menisk te~nosti izjedna~iti sa prvom crtom na gornjem, graduisa-
nom delu stalagmometra. Pa`ljivo ispustiti jednu kap i zapisati koli-
ko podeoka zauzima.
c) Odre|ivanje broja kapi u pro{irenom delu stalagmometra
Povu}i te~nost u gornji, graduisani deo stalagmometra. Zapisati po-
deok iznad pro{irenja na kome se nalazi menisk te~nosti. Obrisati
kap sa donjeg dela stalagmometra i podesiti da te~nost isti~e u kapi-
ma. Brojati kapi, a brojanje zavr{iti kada te~nost u|e u donji, gradui-
sani deo stalagmometra i zapisati broj podeoka. Zbir podeoka iznad
i ispod pro{irenja podeliti brojem podeoka koji zauzima jedna kap.
Ovaj koli~nik, odnosno vi{ak kapi, izra~unat sa ta~no{}u jednog de-
cimalnog mesta, oduzeti od ukupnog broja kapi. Dobijena razlika
predstavlja broj kapi
n
u pro{irenom delu stalagmometra. Broj kapi
n
odrediti tri puta za destilovanu vodu, a zatim izra~unati srednju
vrednost.
Postupak
Stalagmometar isprati sa malo etanola i osu{iti na vakuumu. Odre-
diti broj kapi
n
za analiziranu te~nost na isti na~in kao za destilo-
vanu vodu.
Iz eksperimentalno dobijenih srednjih vrednosti broja kapi, da-
tih vrednosti za gustinu i koeficijent povr{inskog napona vode (tab-
lica 3 u Prilogu) i gustine analizirane te~nosti na radnoj temperatu-
ri, izra~unati koeficijent povr{inskog napona i parahor.
Rezultate prikazati tabelarno.
Medenica / Male{ev
22
Eksperimentalna fizi~ka hemija
23
A
– broj podeoka koje zauzima jedna kap
B
– broj podeoka iznad pro{irenja
C
– broj podeoka ispod pro{irenja
D
– ukupan broj kapi
E
– broj kapi u vi{ku zapremine
[
(
B
+
C
) /
A
]
F
– broj kapi u pro{irenom delu stalagmometra (
n
) (n =
D
–
E
)
t = ........ °C
M = ...... kg mol
-1
Tabela 1.
Odre|ivanje broja kapi u stalagmometru
Voda
Analizirana te~nost
a
b
c
d
e
f
uzorak
broj kapi < n >
P
voda
te~nost
ρ
(kg m
-3
)
σ
(N m
-1
)
Tabela 2.
Povr{inski napon
REZULTATI

Pritisak pare rastvara~a iznad ~istog rastvara~a ve}i je od pritiska pa-
re rastvara~a iznad rastvora, koji sadr`i neisparljivu rastvorenu sup-
stanciju (rastvorak), pod uslovom da su pritisci mereni na istoj tem-
peraturi.
Na osnovu ovih saznanja Raul (Raoult) je dao zakon, koji glasi:
Relativno sni`enje pritiska pare iznad rastvora jednako je odnosu broja
molova rastvorka i ukupnog broja molova rastvara~a i rastvorka
.
Matemati~ka formulacija ovog zakona data je jedna~inom:
gde je:
P
A
0 – pritisak pare iznad rastvara~a
P
A
– pritisak pare iznad rastvora
n
A
– broj molova rastvara~a
n
B
– broj molova rastvorka
n
B
/(n
A
+ n
B
) – molski udeo ili molska frakcija rastvorka.
Iz jedna~ine (1) vidi se da je pritisak pare iznad rastvora
P
A
manji,
kada je
n
B
, odnosno koncentracija rastvora ve}a. Raulov zakon va`i
za razbla`ene rastvore, a sa pove}anjem koncentracije raste i odstu-
panje od ovog zakona.
Posledica smanjenog pritiska pare iznad rastvora je povi{enje tem-
perature klju~anja i sni`enje temperature mr`njenja rastvora (ta~ni-
je rastvara~a u rastvoru) u odnosu na ~ist rastvara~, {to je prikazano
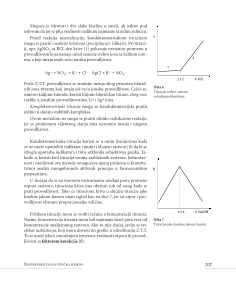
na dijagramu (slika 1).
Eksperimentalna fizi~ka hemija
27
KRIOSKOPIJA
(gr~ki
krios
– mraz i
skopein
– posmatrati)
Teorijski princip
P
0
A
– P
A
P
0
A
n
B
n
A
– n
B
(1)
=
Pritisak pare vode (P
0
) raste sa pove}anjem temperature, sve dok
se na t = 100°C ne izjedna~i sa pritiskom gasne faze, odnosno vaz-
duhom (ta~ka A), koji iznosi 101.325 Pa (jednu atmosferu, odnosno
760 mm `ivinog stuba). Na toj temperaturi voda po~inje da klju~a,
{to zna~i da je uspostavljena ravnote`a izme|u te~ne i gasovite faze.
Po{to je pritisak pare vode (P) iznad rastvora na t = 100°C (ta~ka D)
manji, potrebno je pove}ati temperaturu da bi se pritisak pare izjed-
na~io sa atmosferskim pritiskom (ta~ka C) kada rastvor po~inje da
klju~a. Razlika izme|u temperatura klju~anja vode i rastvora oz-
na~ena je sa
∆
t
klj
.
Pritisak pare iznad vode se smanjuje sa sni`enjem temperature i
kad se izjedna~i sa pritiskom pare iznad leda (ta~ka B), koji iznosi
610,6 Pa na t = 0°C, voda po~inje da kristali{e. Time se uspostavlja
ravnote`a izme|u ~vrste i te~ne faze, dok se sva voda ne pretvori u
led. Vidi se da je odgovaraju}i pritisak pare iznad rastvora (ta~ka E)
manji zbog ~ega je rastvor stabilniji od vode, pa ne podle`e kristali-
zaciji. Na temperaturama ispod 0°C postoji samo led, za koji kriva
napona pare (BF) ima strmiji tok od krive napona pare vode (AB) i
krive napona pare iznad rastvora (CF), jer su promene napona pare
sa promenom temperature ve}e iznad leda nego iznad vode i vo-
Medenica / Male{ev
28
S
Slliik
ka
a 1
1..
Krive P = f(t°C) za vodu
i vodeni rastvor

Iz jedna~ina (4) i (6) dobija se izraz za izra~unavanje molarne mase
rastvorka krioskopskom metodom:
Jedna~ina (7) va`i za razbla`ene rastvore neelektrolita, kao i za
rastvore u kojima kristali{e samo rastvara~, a ne i rastvorak. To se
posti`e izborom rastvara~a, ~ija je ta~ka mr`njenja mnogo ve}a u
odnosu na rastvorak, ~ija se molarna masa odre|uje. U suprotnom
ne}e va`iti Raulov zakon (1), prema kome para iznad rastvora poti~e
samo od rastvara~a, dok se rastvorak smatra neisparljivim.
Povi{enje ta~ke klju~anja i sni`enje ta~ke mr`njenja spadaju u
koligativne osobine
te~nih rastvora. To su osobine koje zavise od
broja ~estica rastvorka prisutnih u odre|enoj zapremini rastvara~a,
a ne zavise od prirode ~estica, njihove veli~ine, oblika, hemijskog
sastava i naelektrisanja.
Na|eno je da su sni`enja ta~ke mr`njenja i povi{enja ta~ke klju-
~anja rastvora slabih i jakih elektrolita ve}a u odnosu na rastvore ne-
elektrolita iste molalne koncentracije, {to se obja{njava pove}anjem
broja ~estica rastvorka u rastvorima elektrolita usled disocijacije
molekula. Zbog odstupanja rastvora elektrolita od Raulovog za-
kona, Van Hof (van’t Hoff ) je uveo korekcioni broj
i
, tako da se jed-
na~ina (2) mo`e primeniti i na rastvore elektrolita:
Van Hofov broj
i
se defini{e kao odnos broja ~estica u rastvoru elek-
trolita i broja ~estica u rastvoru neelektrolita, pri istim molalnim
koncentracijama ovih rastvora. Deljenjem jedna~ine (8) sa jedna~i-
nom (2), dobija se jedna~ina za izra~unavanje broja
i
:
gde su
∆
t’ i
∆
t sni`enja ta~ke mr`njenja rastvora elektrolita, odnosno
neelektrolita istih molalnih koncentracija.
Medenica / Male{ev
30
(7)
M = K
a .
1000
b .
∆
t
(9)
i =
∆
t
’
∆
t
∆
t’ = k . c . i
(8)
Na primer,
∆
t’ razbla`enog rastvora jakog elektrolita NaCl, koji
disosuje na Na
+
i Cl
–
jone, dva puta je ve}e od
∆
t rastvora neelek-
trolita iste koncentracije, pa iz jedna~ine (9) sledi da je i
NaCl
= 2. Za
izra~unavanje molarne mase elektrolita koristi se jedna~ina (7) u
slede}em obliku:
Ebulioskopska metoda
se zasniva na merenju povi{enja ta~ke klju-
~anja rastvora u odnosu na rastvara~. Za odre|ivanje molarne mase
ovom metodom primenjuju se sve jedna~ine date kod krioskopske
metode, osim {to se krioskopska zamenjuje ebulioskopskom kon-
stantom
E
. Ebulioskopska metoda se retko koristi za odre|ivanje
molarne mase, jer je odre|ivanje sni`enja ta~ke mr`njenja mnogo
jednostavnije. Pored toga, vrednosti krioskopskih konstanti rast-
vara~a (K
H
2
O
= 1,86) ve}e su od ebulioskopskih (E
H
2
O
= 0,52).
Zbog toga su osetljivost i ta~nost odre|ivanja molarne mase krio-
skopskom metodom ve}i, jer ve}oj vrednosti konstante rastvara~a
odgovara ve}a vrednost
∆
t, {to se vidi iz jedna~ine (7).
Eksperimentalna fizi~ka hemija
31
(10)
M = K
. i
a .
1000
b .
∆
t

Aparatura i hemikalije
l
Aparat za merenje sni`enja ta~ke mr`njenja po Bekmanu
(Beckmann) (slika 2)
l
Termometar
l
Lupa
l
Hronometar
l
Uzorak za odre|ivanje molarne mase
l
Natrijum-hlorid
l
Led
P
ostupak
Odmeriti na analiti~koj vagi oko 0,4 g supstancije, ~ija se molarna
masa odre|uje, sa ta~no{}u 1×10
-4
g.
Pripremiti aparaturu za merenje sni`enja ta~ke mr`njenja prema
slici 2. U posudu za hla|enje sipati sme{u za hla|enje koju ~ine isit-
njen led i natrijum-hlorid. U sme{u uroniti termometar. Tempera-
tura sme{e treba da se kre}e u intervalu od –3 do –5°C, koja se posti-
`e odre|enom koli~inom natrijum-hlorida u sme{i.
Promene temperature pratiti na Bekmanovom termometru. To je
`ivin termometar koji ima dva rezervoara povezana kapilarom. Ovim
termometrom vr{e se relativna merenja, {to zna~i da se ne mo`e od-
rediti temperatura, ve} samo temperaturska razlika. Skala je gradui-
sana u opsegu od 5 do 6 stepeni. Za o~itavanje desetih i stotih delova
stepena koristiti malu lupu, koja je obi~no pri~vr{}ena za termometar.
Pre svakog merenja potrebno je doterati Bekmanov termometar. To
zna~i da `ivu treba tako rasporediti izme|u dva rezervoara, da se tem-
peratura mr`njenja rastvora na|e na donjoj polovini skale. Time je
omogu}eno pra}enje promene temperature u odre|enim vremen-
skim intervalima i grafi~ko prikazivanje krivih hla|enja.
Pipetom odmeriti 20 mL destilovane vode i preneti je u epruvetu
A. Zatim dodati prethodno odmerenu masu supstancije, vode}i ra-
~una da se sva koli~ina rastvori i da nema ostataka supstancije na zidu
epruvete. Spustiti Bekmanov termometar i me{alicu tako da termo-
metar skoro dodiruje dno epruvete. Vodu me{ati ravnomerno po-
meranjem me{alice gore-dole i pratiti promenu temperature na ter-
mometru. Hronometar uklju~iti kada `ivin konac padne na skalu i
o~itavati temperaturu svakih pola minuta. Temperatura }e stalno
opadati i od momenta kada rastvor po~ne da kristali{e, termometar
}e pokazivati konstantnu vrednost sve dok sva koli~ina rastvora ne
Eksperimentalna fizi~ka hemija
33
iskristali{e. Na ovaj na~in odre|ena je temperatura mr`njenja rast-
vora (t
2
).
Epruvetu A izvaditi zajedno sa Bekmanovim termometrom i
me{alicom i zagrevati u ruci, dok se svi kristali ne istope. Postupak
merenja temperature mr`njenja rastvora ponoviti jo{ jednom.
Epruvetu A, uronjene delove termometra i me{alice oprati od
rastvora obi~nom, pa zatim destilovanom vodom i sipati pribli`no
20 mL destilovane vode. Ponovo spustiti termometar i me{alicu i
odrediti temperaturu mr`njenja vode (t
1
) dva puta.
^esto se de{ava da se temperatura rastvara~a, odnosno rastvora
spusti ispod temperature mr`njenja neposredno pre mr`njenja. Ova
pojava naziva se
prehla|enje
. Kada prehla|ena te~nost po~ne da
kristali{e, temperatura se naglo popne do temperature mr`njenja i
ostaje na toj temperaturi sve dok sva koli~ina ne iskristali{e.
U istom koordinativnom sistemu prikazati krive hla|enja za
rastvara~ i rastvor i odrediti vrednost
∆
t (
∆
t = t
1
– t
2
), a zatim izra-
~unati molarnu masu. Vrednost za krioskopsku konstantu uzeti iz
tablice 4 u Prilogu.
Rezultate prikazati tabelarno i grafi~ki.
Medenica / Male{ev
34

(3)
Termi~ke
osobine rastvora
KALORIMETRIJA
Odre|ivanje toplote rastvaranja
Svaka fizi~ka promena (rastvaranje, promena agregatnog stanja, pre-
laz jedne kristalne modifikacije u drugu) ili hemijska reakcija (sjed-
injavanje, neutralizacija, sagorevanje) pra}ena je energetskim prom-
enama sistema, u kojima se ovi procesi de{avaju. Koli~ina toplote
Q
koju neki sistem primi ili otpusti pri nekom procesu, naziva se
to-
plotni efekat
. Kad raste temperatura sistema, u kome se proces od-
vija, zna~i da sistem odaje deo toplote okolini. Takav proces je
egzo-
terman
. Naprotiv, kad temperatura u toku procesa opada, zna~i da
sistem prima toplotu od okoline, pa je proces
endoterman
.
Metoda za odre|ivanje toplotnog efekta fizi~kih i hemijskih pro-
cesa naziva se
kalorimetrija
, a ure|aj za merenje toplotnog efekta
kalorimetar
. To je izolovan sistem, koji ne razmenjuje toplotu sa
okolinom, ~ime se posti`e ta~no merenje toplotnog efekta. Savr{eno
izolovan, odnosno adijabatski sistem ne mo`e se napraviti, pa je po-
trebno da se proces brzo zavr{i. Pored toga, temperaturska promena,
Eksperimentalna fizi~ka hemija
39
K
KA
AL
LO
OR
RIIM
ME
ET
TR
RIIJJA
A
(latinski
calor
– toplota i gr~ki
metron
– mera)
Teorijski princip
S
Slliik
ka
a 1
1..
Kalorimetar sa vodom
A – spolja{nja metalna posuda
B – za{titna posuda
C – staklena ~a{a
D – Bekmanov termometar
E – lupa
F – me{alica
G – termometar termostata

to iz jedna~ina (1) i (2) sledi izraz za izra~unavanje molarne toplote
rastvaranja:
Toplotni kapacitet
defini{e se kao koli~ina toplote, koju je
potrebno dovesti jednom sistemu, da mu se temperatura povisi za
jedan stepen. U zavisnosti od koli~ine sistema kome se dovodi
toplota, postoji vi{e definicija toplotnog kapaciteta.
Specifi~ni toplotni kapacitet
ili
specifi~na toplota c
odnosi se
na jedan gram supstancije. Po{to toplotni kapacitet zavisi od tem-
perature, na kojoj sistem prima toplotu, posebno je definisana
specifi~na toplota vode c
v
. To je koli~ina toplote potrebna da se
jedan gram vode zagreje od 14,5°C do 15,5°C. Ona iznosi:
Toplotni kapacitet sistema koji sadr`i
m
grama supstancije, dat je
jedna~inom:
Ukupni toplotni kapacitet kalorimetra
C
predstavlja zbir toplot-
nog kapaciteta ~vrstih delova kalorimetra, koji su primili toplotu
C
k
, i toplotnog kapaciteta vode
C
v
:
Prema jedna~ini (5),
C
k
se izra~unava iz izraza:
gde se pod
m
i
podrazumevaju mase ~a{e i uronjenih delova ter-
mometra i me{alice, a
c
i
odgovaraju}e specifi~ne toplote.
Za
C
v
va`i:
gde je:
m
v
– masa vode
c
v
– specifi~na toplota vode.
Eksperimentalna fizi~ka hemija
41
Q =
C
.
∆
t
cor
.
M
m
(3)
c
v
= 1 cal = 4,186 KJ kg
-1
K
-1
(4)
C = m . c
(5)
C = C
k
+ C
v
(6)
C
v
= m
v
. c
v
C
k
=
Σ
m
i
. c
i
(7)
(8)
Po{to je
m
v
poznato, a podaci za
c
v
, u zavisnosti od temperature,
nalaze se u termodinami~kim tablicama (tablica 5 u Prilogu), to je
za izra~unavanje molarne toplote rastvaranja potrebno znati toplot-
ni kapacitet ~vrstih delova kalorimetra
C
k
.
Odre|ivanje toplotnog kapaciteta ~vrstih delova kalorimetra
Za odre|ivanje toplotnog kapaciteta ~vrstih delova kalorimetra
C
k
,
pored drugih metoda, koristi se i tzv.
metoda me{anja
. Toplota koju
neko telo primi ili preda jednaka je proizvodu toplotnog kapaciteta
tela i temperaturske razlike:
Koli~ina toplote koju je topla voda predala hladnoj vodi i ~vrstim
delovima kalorimetra bi}e:
gde je:
m
2
–
masa tople vode
t
2
–
temperatura tople vode
t
–
temperatura sme{e.
Koli~ina toplote koju su primili hladna voda i ~vrsti delovi kalo-
rimetra iznosi:
gde je:
m
1
–
masa hladne vode
t
1
–
temperatura hladne vode.
Na temperaturi sme{e
t
izvr{ena je potpuna razmena toplote.
Mo`e se napisati da je:
Medenica / Male{ev
42
Q
2
= m
2
. c
v
(t
2
– t)
(10)
Q
2
= Q
1
Q = C .
∆
t
(9)
Q
1
= m
1
. c
v
(t – t
1
) + C
k
(t – t
1
)
(11)
(12)

Medenica / Male{ev
44
Aparatura i hemikalije
l
Kalorimetar (slika 1, strana 39)
l
Analizirana supstancija
l
Destilovana voda
Postupak
Odre|ivanje toplotnog kapaciteta kalorimetra vr{i se tako {to se
menzurom odmeri 100 g vode na sobnoj temperaturi, sa ta~no iz-
merenom vredno{}u i prenese u kalorimetar. Zatim uroniti termo-
metar sa opsegom od 50°C i uklju~iti me{alicu. Kontrolisati tempera-
turu svakih pola minuta. Kad se temperatura ustali, naglo sipati 100 g
vode sa ta~no izmerenom temperaturom u intervalu 50–60°C. Pra-
titi porast temperature i odrediti najvi{u temperaturu sme{e hladne
i tople vode, koja zatim polako opada zbog izmene toplote sa okoli-
nom.
Odmeriti 4–6 g supstancije sa ta~no{}u ± 1×10
-3
g (
m
). U kalori-
metarsku ~a{u sipati 300 mL destilovane vode (
m
v
), uroniti Bekma-
nov termometar i uklju~iti me{alicu.
Odmah po~eti sa ~itanjem temperature svakih pola minuta, be-
le`e}i vrednosti prema ta~nosti skale. Posle 10–15 ~itanja, kad se
temperatura ustali, tj. kada razlike izme|u dva uzastopna ~itanja po-
stanu nemerljive, zavr{ena je
po~etna perioda
.
Podi}i poklopac, brzo ubaciti odmerenu masu analizirane sup-
stancije u ~a{u, staviti poklopac i dalje ~itati temperaturu svakih po-
la minuta u kontinuitetu sa po~etnom periodom. Nagla promena
temperature je posledica toplotnog efekta rastvaranja. Da ne bi do-
{lo do ve}e izmene toplote sa okolinom, rastvaranje mora biti brzo.
Ovo je
glavna perioda
i zbog nagle promene temperature prva ~ita-
nja se ne mogu izvesti sa ta~no{}u kao kod po~etne periode.
URADITE SAMOSTALNO ...
Odre|ivanje
toplote
rastvaranja
Zadatak eksperimenta
n
Metodom me{anja odrediti toplotni kapacitet ~vrstih delova ka-
lorimetra.
n
Odrediti molarnu toplotu rastvaranja analizirane supstancije.
Eksperimentalna fizi~ka hemija
45
U
zavr{noj periodi
temperatura se postepeno menja (zbog iz-
mene toplote sa okolinom). ^itanja temperature treba zavr{iti kao i
kod po~etne periode.
Rezultate prikazati tabelarno i grafi~ki.
Grafi~ki prikazati promenu temperature u funkciji vremena i
odrediti
∆
t
cor
na slede}i na~in: povu}i prave kroz najve}i broj ta~aka
po~etne periode, a zatim kroz najve}i broj ta~aka zavr{ne periode.
Paralelno ordinati povu}i pravu koja se~e glavnu periodu, tako da
dve povr{ine P
1
i P
2
budu pribli`no jednake, kao {to pokazuje slika 2.
Rastojanje izme|u ta~aka A i B predstavlja korigovanu temperatur-
sku razliku. Ukupni toplotni kapacitet C izra~unati iz jedna~ina (6),
(8) i (14), a zatim molarnu toplotu rastvaranja Q iz jedna~ine (3).
S
Slliik
ka
a 2
2..
Promena temperature sa vremenom
1 – po~etna
2 – glavna
3 – zavr{na perioda

(4)
Osobine
molekula
REFRAKTOMETRIJA
Odre|ivanje molarne
refrakcije rastvora
POLARIMETRIJA
Odre|ivanje koncentracije
rastvora saharoze
Brzina svetlosti je najve}a u vakuumu, a menja se u zavisnosti od gu-
stine i prirode sredine kroz koju prolazi. Odnos izme|u brzine svet-
losti u vakuumu
c
v
i nekoj sredini
c
s
je konstanta za datu sredinu i
naziva se
apsolutni indeks prelamanja
:
Odnos izme|u brzina svetlosti u bilo kojim dvema sredinama
naziva se
relativni indeks prelamanja
:
i predstavlja konstantu za obe sredine. Promena brzine svetlosnog
zraka, pri njegovom prelazu iz jedne u drugu sredinu, manifestuje se
promenom pravca kretanja (slika 1).
Ako je sredina (2) gu{}a od sredine (1), zrak se prelama ka nor-
mali, tako da je ugao i
1
uvek ve}i od ugla i
2
. Odnos indeksa prela-
manja za ove dve sredine dat je izrazom:
Odatle je:
Veli~ina
n
2,1
predstavlja relativni indeks prelamanja ili, kra}e,
in-
deks prelamanja
ili
indeks refrakcije
i odgovara veli~ini datoj u
jedna~ini (2). Indeks prelamanja zavisi od prirode i jedne i druge
sredine, talasne du`ine svetlosti (va`i samo za monohromatsku svet-
lost) i temperature. Zbog toga je potrebno naglasiti uslove pod koji-
ma je izmeren indeks prelamanja. Naj~e{}e su merenja vr{ena ko-
riste}i `utu natrijumovu D liniju, ~ija talasna du`ina
λ
D
iznosi 589,3
nm i na sobnoj temperaturi od 20°C ili 25°C. Tako odre|en indeks
prelamanja ozna~ava se simbolima n
D
20
ili n
D
25
.
Eksperimentalna fizi~ka hemija
49
REFRAKTOMETRIJA
(latinski
refractus
– prelomljen)
Teorijski princip
Slika 1.
Prelamanje svetlosnog zraka
(1)
c
v
c
s
n
aps
=
(2)
c
1
c
2
n
rel
=
(4)
sin i
1
sin i
2
=
= n
2
,
1
n
2
n
1
(3)
n
1
. sin i
1
= n
2
. sin i
2

veza koje postoje u molekulu). Zahvaljuju}i ovim osobinama, mo-
larna refrakcija se koristi za odre|ivanje strukture organskih jed-
injenja. Na primer, u homologom nizu alkohola svaka CH
2
grupa
pove}ava vrednost R
m
za oko 4,634. Aditivnost i konstitutivnost
molarne refrakcije ogledaju se u dobrom slaganju izra~unate R
m
vrednosti iz izmerenih indeksa refrakcije (jedna~ina 6) i izra~unate
vrednosti iz atomskih refrakcija. Na primer, eksperimentalna R
m
vrednost za benzol iznosi 26,15, a izra~unata 26,31, pod uslovom da
su merenja indeksa prelamanja izvr{ena koriste}i natrijumovu D
liniju (n
D
).
Pomo}u molarne refrakcije mogu se identifikovati izomerni ob-
lici nekog jedinjenja ili odrediti koji tautomerni oblik dominira u je-
dinjenju.
Po{to indeks prelamanja zavisi od talasne du`ine propu{tene
svetlosti i veli~ine koje su izvedene iz indeksa prelamanja, specifi~na
i molarna refrakcija tako|e zavise od talasne du`ine. Razlika speci-
fi~nih refrakcija na dve talasne du`ine, r
λ
1
– r
λ
2
, naziva se
specifi~na
disperzija
, a razlika molarnih refrakcija, R
λ
1
– R
λ
2
,
molarna dis-
perzija
. Obe disperzije imaju svojstvo aditivnosti i koriste se pri
odre|ivanju tipa veze atoma u molekulu.
Aditivne i konstitutivne osobine molarne refrakcije mogu se ko-
ristiti za odre|ivanje sastava sme{e. Molarna refrakcija sme{e dve
te~nosti data je izrazom:
gde je:
R
1,2
– molarna refrakcija sme{e
n – indeks prelamanja sme{e
x
1
i x
2
– molski udeo komponente 1 i 2
M
1
i M
2
– molarna masa komponente 1 i 2.
Utvr|eno je da veli~ina R
1,2
predstavlja zbir doprinosa pojedi-
na~nih konstituenata:
gde su R
1
i R
2
molarne refrakcije komponenata 1 i 2.
Eksperimentalna fizi~ka hemija
51
R
1,2
=
.
n
2
– 1
n
2
+ 2
x
1
M
1
+ x
2
M
2
ρ
1
,,
2
(7)
R
1,2
= x
1
R
1
+ x
2
R
2
(8)
Iz izmerenih vrednosti indeksa prelamanja sme{e, indeksa prela-
manja pojedina~nih komponenata, gustine sme{e, gustine pojedi-
na~nih komponenata i molarnih masa komponenata, prvo se mogu
izra~unati molarne refrakcije komponenata iz jedna~ine (6), a po-
tom i molski udeli komponenata, odnosno sastav sme{e, pomo}u
jedna~ina (7) i (8). Ove jedna~ine va`e pod uslovom da zapremina
sme{e predstavlja aditivnu vrednost zapremina komponenata. U
tom slu~aju, za indeks prelamanja sme{e va`i izraz:
gde su:
n
1
i n
2
– indeksi prelamanja te~nosti 1 i 2
V
1
i V
2
– zapremine te~nosti 1 i 2.
Indeks prelamanja odre|uje se pomo}u opti~kog instrumenta
koji se naziva
refraktometar
. Najprostiji tipovi refraktometara su
Abeov
(Abbe),
Pulfrihov
(Pulfrich) i
imerzioni refraktometar
. Odre-
|ivanje indeksa prelamanja
n
neke te~nosti zasniva se na merenju
grani~nog ugla i
gr
pri prelasku svetlosti iz ispitivane te~nosti u stak-
lenu prizmu poznatog indeksa prelamanja
N
(slika 2). Grani~ni
ugao
i
gr
je najve}i ugao pod kojim se mo`e prelomiti zrak kad pre-
lazi iz jedne sredine u drugu. Da bi se to postiglo, svetlost mora pa-
dati na dodirnu povr{inu dve sredine skoro paralelno, odnosno pod
uglom od 90° u odnosu na normalu. [rafirani deo predstavlja ne-
osvetljeni deo prizme. Ako bi se svetlost kretala suprotnim smerom,
odnosno prelazila iz prizme u te~nost, zraci koji padaju pod uglom
ve}im od grani~nog ne bi mogli pre}i u te~nost, ve} bi se odbijali od
povr{ine prizme i ponovo u nju vratili, {to je poznato pod imenom
totalna refleksija
.
Kada se jedna~ina (3) za prelamanje svetlosti primeni na sliku 2,
va`i:
Po{to je sin 90° = 1, bi}e:
Medenica / Male{ev
52
n =
n
1
V
1
+
n
2
V
2
V
1
+ V
2
(9)
Slika 2.
Put grani~nog zraka
(10)
n .
sin 90°
= N .
sin
i
gr
(11)
n = N .
sin
i
gr

Izvor svetlosti
W
mo`e biti bela svetlost, sun~eva ili obi~na vol-
framova sijalica. Svetlosni zraci reflektovani sa ogledala
O
prolaze
kroz prizmu
Q
, ~ija je gornja povr{ina grubo izbru{ena. Ova povr-
{ina slu`i kao izvor svetlosnih zraka koji prolaze kroz sloj te~nosti
debljine 0,1 mm i prelamaju se na poliranoj povr{ini prizme
P
.
Maksimalan ugao pod kojim se zrak prelama u prizmi
P
predstavlja
grani~ni ugao
, koji stvara granicu izme|u levog tamnog dela, i de-
snog svetlog dela vidnog polja
L
. Na granici prizma
P
– vazduh, zraci
se ponovo prelamaju i prolaze kroz teleskop
T
u kome se nalaze roti-
raju}e Ami}ijeve (Amici) prizme
A
1
i
A
2
, koje propu{taju monohro-
matsku svetlost. Po prolasku kroz prizme, svetlost pada na vidno
polje
L
sa ukr{tenim kon~anicama
K
1
i
K
2
.
Odre|ivanje indeksa prelamanja te~nosti vr{i se tako {to se
prizme Q i P obr}u do pojave grani~nog ugla, odnosno granice iz-
me|u tamnog i svetlog polja na vidnom polju L. Ako svetlost nije
monohromatska, ova granica nije o{tra i sadr`i spektar boja. Zbog
toga se vr{i obrtanje Ami}ijevih prizmi, koje pod izvesnim uglom
propu{taju samo natrijumovu D liniju od 589,3 nm. Propu{tanje
monohromatske svetlosti manifestuje se pojavom o{tre granice iz-
me|u tamnog i svetlog dela vidnog polja. Pomo}u rotiraju}ih priz-
mi Q i P, grani~na linija se ponovo pomeri, tako da se dovede u ta~ku
preseka kon~anica, a zatim se na skali S direktno pro~ita indeks pre-
lamanja te~nosti.
Medenica / Male{ev
54
Aparatura i hemikalije
l
Abeov refraktometar (slika 4)
l
Analizirani rastvor
Priprema Abeovog refraktometra
Odvrnuti zavrtanj koji spaja prizme, odvojiti donju prizmu Q od
gornje P i »lenz« papirom (papir za brisanje opti~kih povr{ina) ili
vatom natopljenom etanolom, obrisati obe prizme. Sa~ekati da se
prizme osu{e isparavanjem etanola. Pipetom naneti analiziranu te~-
nost na celu povr{inu donje prizme Q, ne dodiruju}i prizmu pipe-
tom. Podi}i donju prizmu i pri~vrstiti je zavrtnjem za gornju.
Merenje indeksa prelamanja
Zavrtanj na levoj strani refraktometra okretati sve dok se na vidnom
polju desnog okulara ne pojavi granica tamno-svetlo. Zavrtnjem na
desnoj strani instrumenta izo{triti granicu. Ponovo zavrtnjem sa le-
ve strane prizme podesiti granicu {to je mogu}e preciznije na presek
kon~anica (dveju unakrsnih crnih linija). Indeks prelamanja o~itava
se na levom okularu (leva skala), sa ta~no{}u koja karakteri{e instru-
ment (1×10
-4
).
Eksperimentalna fizi~ka hemija
55
URADITE SAMOSTALNO ...
Odre|ivanje molarne
refrakcije rastvora
Zadatak eksperimenta
n
Izmeriti deset puta vrednosti indeksa prelamanja analiziranog
uzorka na sobnoj temperaturi.
n
Odbaciti one vrednosti indeksa prelamanja koje najvi{e
odstupaju i izra~unati srednju vrednost <n> (poglavlje
Statisti~ka
obrada rezultata
u Prilogu). Iz poznate vrednosti molarne mase i
gustine izra~unati molarnu refrakciju Rm (eksp.).
n
Statisti~kom obradom dobijenih rezultata, metodom
»Studentove t-raspodele«, izra~unati ta~nost odre|ivanja indeksa
prelamanja.
n
Na osnovu strukturne formule ispitivanog jedinjenja izra~unati
molarnu refakciju Rm (izra~.).

Na osnovu poznate strukturne formule i tabli~nih vrednosti re-
frakcija atoma i veza (tablica 6 u Prilogu) izra~unati molarnu refrak-
ciju
Rm
i
(izra~unato)
.
Na osnovu razlike
∆
Rm = Rm
e
– Rm
i
i tabli~nih vrednosti mo-
larnih refrakcija veza, odrediti broj dvostrukih veza.
Rezultate prikazati tabelarno.
Eksperimentalna fizi~ka hemija
57
Medenica / Male{ev
58
Merenje
Indeks prelamanja
(n)
∆
n
∆
2
n
1
2
3
4
5
6
7
8
9
10
< n >
<n>
M (kg mol
-1
)
ρ
(kg m
-3
)
Rm (m
3
mol
-1
)
eksperimentalno
izra~unato
∆
Rm (m
3
mol
-1
)
BROJ
(=)
VEZA
T
Ta
ab
be
ella
a 1
1..
Rezultati merenja
T
Ta
ab
be
ella
a 2
2..
Rezultati za molarnu refrakciju
REZULTATI
Jedinjenje____________________

Transverzalni talas
nastaje kad ~estice osciluju u pravcu koji je nor-
malan na pravac prostiranja talasa. Osobine talasnog kretanja u me-
hanici mogu se preneti na svetlost, koja predstavlja talasno kretanje
elektromagnetske prirode.
Svetlosni talas
se sastoji od dva spregnu-
ta talasa, elektri~nog i magnetskog, koji se prostiru u ravnima koje
su me|usobno normalne. Po{to su elektri~ne i magnetske oscilacije
normalne na pravac prostiranja svetlosti, mo`e se smatrati da i svet-
lost ima osobine transverzalnog talasa. Na slici 1 prikazan je jedan
svetlosni talas, koji emituje jedan atom, kao elektri~ni oscilator.
U ravni koja je normalna na put prostiranja svetlosti, elektri~ne i
magnetske oscilacije jednog svetlosnog talasa normalne su jedna u
odnosu na drugu (slika 2).
Radi jednostavnijeg izlaganja, u daljem tekstu bi}e prikazan sa-
mo elektri~ni talas u obliku vektora, pri ~emu treba uzeti u obzir da
je magnetski talas uvek spregnut sa elektri~nim, kao i da mu je pra-
vac oscilovanja normalan na pravac oscilovanja elektri~nog talasa.
U tom smislu, pojednostavljena orijentacija svetlosnog talasa prika-
zana je na slici 3.
Eksperimentalna fizi~ka hemija
61
POLARIMETRIJA
(latinski
polaris
– polarizacija i gr~ki
metria
– merenje)
Teorijski princip
Slika 1.
Svetlosni talas
λ
– talasna du`ina svetlosti
E – amplituda elektri~ne oscilacije
H – amplituda magnetske oscilacije
Slika 2.
Orijentacija svetlosnog talasa
Slika 3.
Orijentacija elektri~nih oscilacija
jednog svetlosnog talasa
Ako se uzme u obzir ogroman broj atoma koji su razli~ito orijen-
tisani u momentu emisije talasa, mo`e se zaklju~iti da se svetlost sas-
toji od velikog broja talasa, ~iji su vektori ravnomerno orijentisani u
svim pravcima, kao na slici 4.
Kad se monohromatska svetlost, a to je veliki broj talasa iste talas-
ne du`ine, propusti kroz jednu vrstu filtera, koji se zove
polaroid
, ta-
da se svi razli~ito orijentisani svetlosni talasi (prikazani na slici 4)
orijenti{u u istom pravcu, tako da se pona{aju kao jedan talas (slika 3).
Takva svetlost naziva se
linearno polarizovana
, {to zna~i da su elek-
tri~ne i magnetske oscilacije usmerene u jednom pravcu, du` celog
puta prostiranja svetlosti. Drugim re~ima, svetlosni vektor (slika 3)
ne menja svoj pravac u slu~aju kad je svetlost linearno polarizovana.
Ravan u kojoj osciluje linearno polarizovan zrak naziva se
ravan
oscilovanja S
0
, dok se ravan koja stoji normalno na ravan
S
0
zove
ravan polarizacije S
p
, kao na slici 5.
Proces kojim se obi~na svetlost prevodi u polarizovanu naziva se
polarizacija
, a osobinu da se polarizuje ima samo transverzalni ta-
las.
Polaroid se sastoji od vi{e plo~a od stakla ili nekog drugog pro-
zra~nog materijala. Kad svetlosni zrak padne pod uglom na povr{i-
nu prve plo~e, jedan deo zraka se odbije, a drugi, mnogo ve}i deo
svetlosti, pro|e kroz plo~u. Oba zraka se delimi~no polarizuju, a nji-
hove ravni oscilacije su me|usobno normalne. Pri prolazu kroz dru-
gu plo~u polarizacija propu{tenog zraka je jo{ bolja, tako da se pri
izlasku iz polaroida dobija pribli`no linearno polarizovana svetlost.
Mnogi kristali imaju osobinu da polarizuju svetlost. Pri prolasku
kroz islandski kalcit, kvarc, liskun i turmalin, svetlost se razla`e u
dva zraka, od kojih prvi ima iste brzine u svim pravcima kristala i
zove se
redovan
, dok drugi ima razli~ite brzine, u zavisnosti od
pravca kretanja kroz kristal i zove se
neredovan
zrak. Oba zraka su
linearno polarizovana i po izlasku iz kristala se sjedinjuju. Me|utim,
njihove ravni polarizacije su me|usobno upravne, pa je za dobijanje
linearno polarizovane svetlosti potrebno jedan zrak ukloniti. To je
postigao Nikol (Nicol) koji je kristal islandskog kalcita prvo izrezao
tako da dve suprotne ravni stoje pod uglom od 68° prema prirodnim
ravnima kristala. Prizma je, zatim, prerezana po dijagonali, tako da
zahvata ugao od 90° prema spolja{njim ravnima. Prerezane povr{ine
su ugla~ane, pa slepljene prozra~nim kanada-balzamom (slika 6).
Nepolarizovan zrak se, pri prolasku kroz
Nikolovu prizmu
, razla`e
na redovan i neredovan zrak, pri ~emu se redovan zrak totalno re-
flektuje na grani~noj povr{ini izme|u kalcita i kanada-balzama, a
zatim apsorbuje u crnom omota~u prizme. Neredovan zrak prolazi
Medenica / Male{ev
62
Slika 4.
Ravnomerne orijentacije svetlosnih ta-
lasa u svetlosnom zraku
Slika 5.
Ravan oscilovanja S
0
i ravan polarizacije S
p

Neke supstancije pokazuju osobinu da za izvestan ugao okre}u
ravan oscilacije propu{tene polarizovane svetlosti. Ova pojava nazi-
va se
opti~ka rotacija
, a supstancije
opti~ke aktivne
. To su npr. kvarc,
cinober, natrijum-hlorat, terpentin, kristalni {e}er, rastvor {e}era,
strihnin-sulfat i dr. Neke od ovih supstancija okre}u ravan polarizo-
vane svetlosti ulevo, a neke udesno, ako se gleda u pravcu prostiranja
zraka. Za prve se ka`e da su
levogire
, odnosno da imaju
levu
ili
ne-
gativnu rotaciju
, a za druge da su
desnogire
, tj. da imaju
desnu
ili
pozitivnu rotaciju
.
Postoje supstancije koje su iste po sastavu, a mogu imati suprot-
ne smerove rotacije. Na primer, neki kristali kvarca mogu imati levu,
a neki desnu rotaciju.
Opti~ku aktivnost pokazuju jedinjenja sa asimetri~nom struk-
turom molekula. U mnogim organskim jedinjenjima opti~ka aktiv-
nost poti~e od asimetri~nog ugljenikovog atoma, tj. onog koji je ve-
zan za ~etiri razli~ita atoma ili grupe. Pored ugljenika i atomi drugih
elemenata (N, P, S, Co, Te, Pt) mogu stvoriti jedan ili vi{e asimetri~-
nih ili hiralnih centara u molekulu.
Kada se rastvor opti~ki aktivne supstancije stavi izme|u polari-
zatora i analizatora, ravan oscilacije polarizovanog zraka bi}e pome-
rena za izvestan ugao, zbog ~ega }e intenzitet polarizovane svetlosti
po prolasku kroz analizator biti smanjen. To je shematski prikazano
na slici 9.
Medenica / Male{ev
64
Slika 8.
Ga{enje polarizovane svetlosti
u analizatoru
Ako se opti~ki aktivna supstancija (npr. {e}er) nalazi u rastvoru,
tada je veli~ina tzv.
ugla rotacije (obrtanja, skretanja)
ravni oscila-
cije polarizovane svetlosti
α
, koja se izra`ava u radijanima, data jed-
na~inom:
gde je:
l
– du`ina stuba rastvora u
[
dm
]
c – koncentracija opti~ki aktivne supstancije u
[
gr cm
-3
]
[α]
– konstanta srazmere. Naziva se
specifi~na rotacija
ili
specifi~ni
ugao rotacije (obrtanja, skretanja)
. Zavisi od prirode supstancije,
talasne du`ine monohromatske svetlosti polarizovane pre prolaska
kroz rastvor, kao i temperature rastvora.
Prema jedna~ini (1), specifi~na rotacija defini{e se kao ugao rota-
cije polarizovane svetlosti
α
, koji izazove rastvor opti~ki aktivne sup-
stancije, ako je du`ina stuba rastvora kroz koji svetlost prolazi 1 dm,
a koncentracija rastvora iznosi 1 gr cm
-3
. Po{to se veli~ina
[α]
iz-
ra`ava u SI jedinicama, prera~unavanje se vr{i tako {to se broj grama
pretvori u kilograme, broj kubnih centimetara u kubne metre, a broj
decimetara u metre, tako da
[α]
ima dimenzije: rad m
2
kg
-1
.
Standardni izvori monohromatske svetlosti su `ivina lampa sa
zelenom linijom (
λ
= 546,1 nm) i natrijumova lampa sa `utom D
linijom (
λ
srednje
= 589,3 nm). Ako se za merenje ugla rotacije
α
ko-
risti natrijumova lampa, a temperatura rastvora iznosi 20°C, onda se
specifi~na rotacija obele`ava
[α]
D
20
. Specifi~na rotacija zavisi od ta-
lasne du`ine svetlosti i ova pojava naziva se
rotaciona disperzija
.
Eksperimentalna fizi~ka hemija
65
Slika 9.
Skretanje ravni oscilacije polarizovane
svetlosti pri prolasku kroz opti~ki
aktivnu supstanciju
NZ – nepolarizovan zrak
P – polarizator
LPZ
1
– linearno polarizovan zrak
PC – polarimetarska cev sa opti~ki
aktivnom supstancijom
A – analizator
LPZ
2
– skretanje ravni linearno
polarizovanog zraka za ugao
α
α
=
[α]
.
l
. c
(1)

Monohromatski zrak svetlosnog izvora
L
(naj~e{}e natrijumova
lampa) prolazi kroz kolimatorsko so~ivo
K
, koje svetlost u paralel-
nim zracima usmerava ka polarizatoru
P
. Ako polarizovana svetlost
prolazi kroz polarimetarsku cev
C
sa vodom, koja nije opti~ki aktiv-
na, polarizator
P
i analizator
A
postave se u paralelan polo`aj (slika
7), tako da im se opti~ke ose poklapaju. To se posti`e tako {to se po-
kretna kru`na skala
S
, koja je povezana sa analizatorom, podesi da
pokazuje nulu (
α
= 0°). Pri ovim uslovima, polarizovana svetlost
neometano prolazi kroz vodu i analizator i maksimalno osvetljava
vidno polje okulara O.
Pri prolasku polarizovane svetlosti kroz opti~ki aktivan rastvor,
ravan oscilacije polarizovanog zraka skrenu}e za izvestan ugao u od-
nosu na opti~ku osu analizatora, zbog ~ega }e do okulara sti}i polari-
zovana svetlost manjeg intenziteta od maksimalnog. Kada bi ljudsko
oko imalo mo} pam}enja intenziteta svetlosti, analizator bi se po-
mo}u kru`ne skale mogao okrenuti za izvestan ugao
α
, tako da oku-
lar ponovo bude osvetljen kao kad je u cevi bila voda. To bi zna~ilo
da je ponovo do{lo do poklapanja ravni oscilacije polarizovane svet-
losti sa opti~kom osom analizatora, a ugao koji se pro~ita na kru`noj
skali bio bi jednak uglu rotacije
α
opti~ki aktivne supstancije.
Me|utim, ljudsko oko je u stanju da uo~ava samo razlike intenzi-
teta svetlosti. Zato je uz polarizator postavljena mala prizma
P’
, koja
pokriva polovinu vidnog polja okulara. Opti~ka osa prizme
P’
zak-
lapa ugao od 2° do 3° sa opti~kom osom polarizatora. Ako se anali-
zator postavi u ukr{ten polo`aj sa polarizatorom (opti~ke ose im se
nalaze pod uglom od 90°), tamnija }e biti ona polovina vidnog polja
koju ne pokriva prizma
P’
. Ako se analizator postavi u ukr{ten polo-
`aj sa prizmom
P’
, bi}e tamnija polovina vidnog polja koju ona po-
kriva. Izme|u ova dva polo`aja postoji srednji, za koji su obe polovine
vidnog polja okulara podjednako osvetljene. Ovaj polo`aj je obele-
`en nulom instrumenta na pokretnoj kru`noj skali
S
, pod uslovom
da se u polarimetarskoj cevi ne nalazi opti~ki aktivna supstancija,
odnosno kad je u cevi voda. Kad se u cev sipa rastvor opti~ki aktivne
supstancije, jedna polovina vidnog polja bi}e tamnija od druge. Po-
kretni analizator se pomo}u kru`ne skale
S
dovede u polo`aj da obe
polovine vidnog polja okulara budu podjednako osvetljene, ~ime je
ravan oscilacije polarizovane svetlosti ponovo postavljena pod isti
ugao u odnosu na opti~ku osu analizatora, kao kad je homogena os-
vetljenost vidnog polja pode{ena u odnosu na vodu. Ovaj ugao na
kru`noj skali predstavlja ugao rotacije
α
, iz koga se pomo}u jedna-
~ine (2) izra~unava procentna koncentracija opti~ki aktivnog rast-
vora.
Eksperimentalna fizi~ka hemija
67
Polarimetrija se koristi za kvalitativnu i kvantitativnu analizu op-
ti~ki aktivnih jedinjenja, a naro~ito je zna~ajna u obja{njenju stereo-
hemijske strukture opti~kih izomera. U industriji hrane, vo}nih so-
kova i {e}era koristi se za kvantitativnu analizu. Veoma je zna~ajna u
farmaceutskim istra`ivanjima, tako da farmakopeje propisuju ovu
metoda za ispitivanje i kontrolu opti~ki aktivnih jedinjenja, kao {to
su {e}eri, kamfor, etarska ulja i dr. Postoje polarimetri koji su speci-
jalno namenjeni za odre|ivanje koncentracije {e}era. Zovu se
saha-
rimetri
, a skala im je tako kalibrisana da, pri odre|enim uslovima
merenja, na skali neposredno pokazuju sadr`aj {e}era u uzorku koji
se ispituje.
Medenica / Male{ev
68

Postupak
Uklju~iti natrijumovu lampu preko prekida~a na transformatoru.
Polarimetarsku cev otvoriti sa jedne strane (paziti da se ne polo-
mi staklena plo~ica), isprati sa malo analizirane te~nosti, napuniti je
i zatvoriti tako da ne ostane nimalo vazduha. Cev oprati destilova-
nom vodom i obrisati je, posebno plo~ice koje moraju biti potpuno
~iste. Cev staviti u aparat, a zatim nulu nonijusa poklopiti sa nulom
skale.
Merenja otpo~eti tek kada se dobije intenzivno `uta svetlost lam-
pe. Pomo}u okulara, pomeraju}i ga napred-nazad, podesiti maksi-
malnu o{trinu granice tamnog i svetlog polja. Pomeranjem poluge
pokretne skale udesno, izjedna~iti osvetljenost oba polja i na skali
pomo}u nonijusa pro~itati ugao skretanja ravni polarizovane svet-
losti
α
. Postupak ponoviti deset puta.
Izra~unavanje
Za pet vrednosti ugla
α
sa najmanjom apsolutnom gre{kom izra~u-
nati koncentracije, a zatim standardnu devijaciju (poglavlje
Stati-
sti~ka obrada rezultata
u Prilogu):
gde je:
c
i
– koncentracija pojedina~nih merenja
< c > – srednja vrednost izra~unatih koncentracija
n – broj merenja.
Izra~unati standardnu devijaciju srednje vrednosti, tj. gre{ku od-
re|ivanja koncentracije:
Podatak za du`inu cevi dat je na samoj cevi (
l
= 200 mm), a spe-
cifi~na rotacija saharoze iznosi
[α]
= 66,5°.
Rezultate prikazati tabelarno.
Medenica / Male{ev
70
S = ±
Σ
n
i = 1
(c
i
– <c>)
2
n –
1
S
<c>
=
S
n
* (°) =
π
rad/180
l
= 200 mm
[α]
= 66,5°×10
-2
m
2
kg
-1
Eksperimentalna fizi~ka hemija
71
M
ERENJE
α
(°)*
c
i
(%)
c
i
– < c > (%)
S (%)
< c > ± S (%)
S
< c >
(%)
–
1
2
3
4
5
6
7
8
9
10
< >
Tabela 1.
Rezultati merenja
REZULTATI

Kolorimetrija
je vizuelna metoda kojom se na osnovu intenziteta
boje rastvora mo`e odrediti njegova koncentracija. U tu svrhu ko-
riste se instrumenti –
kolorimetri
pomo}u kojih se vr{i pore|enje
intenziteta boje ispitivanog rastvora i rastvora standarda. Po{to se
kao indikator koristi ljudsko oko, ova metoda ne mo`e se smatrati
dovoljno ta~nom. Danas su ovi instrumenti potisnuti iz laboratorija
savremenim fotometrima i spektrofotometrima.
Boja je vizuelni utisak koji se stvara u oku, a javlja se kao posledi-
ca selektivne apsorpcije svetlosti odgovaraju}ih talasnih du`ina
upadne svetlosti (slika 1).
Ako predmet, osvetljen belom svetlo{}u (vidljivi deo spektra),
ostavlja utisak `ute boje zna~i da je propustio `uti deo, odnosno ap-
sorbovao je plavi deo vidljivog spektra. Ako predmet izgleda beo,
zna~i da je upadna svetlost svih talasnih du`ina podjednako pro-
pu{tena ili reflektovana. Naprotiv, ako je predmet crn, zna~i da je ap-
sorbovao upadnu svetlost svih talasnih du`ina.
Ako snop monohromatskog zra~enja (ta~no definisane talasne
du`ine) intenziteta I
0
pada na neko providno telo, jednim delom
bi}e reflektovan (
I
R
), jednim delom apsorbovan (
I
A
), a ostali deo
propu{ten (
I
P
) (slika 2):
Eksperimentalna fizi~ka hemija
75
KOLORIMETRIJA
(latinski
color
- boja i gr~ki
metria
- merenje)
Teorijski princip
Slika 1.
Boja kao posledica selektivne
apsorpcije svetlosti
Y
Y
apsorbuje
plavo
apsorbuje
crveno
bela
svetlost
h
ν
Taraxacum officinale
, masla~ak
Deljenjem ovog izraza sa I
0
sledi:
Prvi ~lan predstavlja refleksionu, drugi apsorpcionu, a tre}i tran-
sparentnu mo} providnog tela (slika 2). Intenzitet reflektovane svet-
losti
I
R
je relativno mali, pa se izraz
I
R
/
I
0
mo`e zanemariti.
Smanjenje intenziteta zra~enja, pri prolasku kroz sloj providnog
tela odre|ene debljine (slika 3), definisano je Lamberovim (Lam-
bert) zakonom:
gde je:
k – konstanta srazmere koja zavisi od talasne du`ine upadne svet
losti, prirode supstancije i temperature
I – intenzitet propu{tene svetlosti
dI – deo intenziteta upadne svetlosti koji je apsorbovan
db – debljina sloja kroz koji prolazi svetlost, tzv. du`ina opti~kog puta.
Koeficijent apsorpcije dI/db ima negativan predznak jer je obr-
nuto srazmeran intenzitetu propu{tene svetlosti I.
Preure|enjem i integraljenjem jedna~ine (3) u granicama od I
0
do I
p
i b od 0 do b dobija se:
pri ~emu je I
0
intenzitet upadne, a I
p
intenzitet propu{tene svetlosti,
odnosno:
Prelaskom na dekadne logaritme dobija se:
Medenica / Male{ev
76
I
0
= I
R
+ I
A
+ I
P
(1)
(2)
I
0
I
0
I
0
I
A
I
P
I
R
+
+
= 1
Slika 2.
Raspodela upadne svetlosti
pri prolasku svetlosnog zraka
kroz providnu sredinu
dI
db
–
= k . I
(3)
dI
I
(4)
Slika 3.
Smanjenje intenziteta zra~enja
I+dI – intenzitet upadne svetlosti
∫
–
I
p
I
0
∫
b
0
= k
db
I
p
I
0
(5)
= k . b
– ln
I
0
I
p
(6)
= k . b
2,303 log

Apsorpcioni koeficijent
ili
apsorptivnost a
je karakteristi~na
veli~ina za svaku molekulsku vrstu i zavisi od prirode rastvorene sup-
stancije, talasne du`ine svetlosti i temperature. Data je jedna~inom:
i defini{e se kao apsorbancija pri prolazu svetlosti kroz sloj jedini~ne
debljine i jedini~ne koncentracije rastvora. Ako se koncentracija iz-
ra`ava u mol L
–1
, naziva se
molarni apsorpcioni koeficijent
.
Jedna~ina (11) predstavlja matemati~ku formulaciju Lamber-
Berovog zakona. Apsorbancija pokazuje linearnu zavisnost od kon-
centracije odre|ene molekulske vrste, pri prolasku monohromatske
svetlosti (ta~no definisane talasne du`ine), pri stalnoj debljini sloja i
temperature. Smanjenje intenziteta propu{tene svetlosti srazmerno
je broju ~estica u jedinici zapremine rastvora, odnosno koncentraciji
rastvora.
U tabeli 1 date su definicije parametara Lamber-Berovog zakona.
Medenica / Male{ev
78
A
b . c
(12)
a =
Tabela 1.
Veli~ine Lamber-Berovog
zakona
Naziv
Simbol
Sinonim
Definicija
Matemati~ka
definicija
Propustljivost
T
Transparencija
Providnost
Deo upadne svetlosti koji je
propu{ten
Opacitet
O
–
Recipro~na vrednost transparencije
Apsorpcija
Aps%
–
Deo upadne svetlosti koji je
apsorbovan
Apsorbancija
A
Ekstinkcija (E)
Opti~ka gustina (OD)
Dekadni logaritam odnosa
upadne i propu{tene svetlosti
Molarna apsorptivnost
a
Molarni apsorpcioni
koeficijent
Ekstinkcioni koeficijent (
ε
)
Apsorbancija rastvora ~ija je
koncentracija 1 mol L
–1
, a debljina
sloja 1 cm na definisanoj talasnoj
du`ini
Du`ina opti~kog puta
b
Debljina sloja
Debljina kivete
Du`ina puta kojim prolazi svetlost
kroz odre|enu sredinu
b
I
p
I
0
T
=
I
0
I
p
O =
I
0
I
p
A =
log
A
b . c
A =
I
0
–
I
p
I
0
Grafi~ki prikaz Lamber-Berovog zakona predstavljen je na slici 4.
Punom linijom prikazana je linearna zavisnost apsorbancije od
koncentracije i predstavlja tzv.
kalibracionu pravu
za odre|enu ta-
lasnu du`inu. Isprekidani delovi krive pokazuju odstupanje od
Lamber-Berovog zakona, koje mo`e nastati usled hemijskih prome-
na npr. disocijacije molekula kod malih koncentracija rastvora ili
pak kod ve}ih koncentracija usled asocijacije, polimerizacije ili stva-
ranja kompleksa. Svako odstupanje od prave linije pokazuje da se is-
pitivana supstancija, u toj oblasti koncentracija, ne pona{a po Lam-
ber-Berovom zakonu.
Kolorimetrijska metoda se zasniva na Lamber-Berovom zakonu.
Koristi se metoda standarda, koja se zasniva na izjedna~avanju in-
tenziteta propu{tene svetlosti kroz uzorak i standard. U tu svrhu
naj~e{}e se koristi
Diboskov
(Dubosq)
kolorimetar
(slika 5).
Eksperimentalna fizi~ka hemija
79
Slika 4.
Promena apsorbancije
sa koncentracijom rastvora
Slika 5.
Shema Diboskovog kolorimetra

Eksperimentalna fizi~ka hemija
81
URADITE SAMOSTALNO ...
Odre|ivanje
koncentracije
obojenog rastvora
Zadatak eksperimenta
n
Pri debljinama sloja standardnog rastvora od b
s
= 10 i b
s
= 15
po deset puta izmeriti odgovaraju}e debljine slojeva b
x
analiziranog rastvora. Iz srednjih vrednosti < b
x
>, za
odgovaraju}e debljine slojeva b
s
= 10 i b
s
= 15, izra~unati
procentne koncentracije analiziranog rastvora c
x
.
n
Iz jedne od dve serije po deset izmerenih vrednosti za b
x
izdvojiti pet najpribli`nijih i izra~unati standardnu devijaciju S.
Slika 6.
Diboskov kolorimetar
1 – ogledalo
2 – kiveta
3 – cilindri~na prizma
4 – okular
2
1
3
4
Aparatura i hemikalije
l
Diboskov kolorimetar (slike 5 i 6)
l
Obojen rastvor poznate i nepoznate koncentracije
Kalibracija kolorimetra
Prizme i kivete pa`ljivo oprati destilovanom vodom, a zatim rastvo-
rom poznate koncentracije (standardom). U obe kivete sipati stan-
dardni rastvor, a zatim pomo}u levog i desnog zavrtnja spustiti priz-
me tako da debljine slojeva (rastojanje od dna kivete do donje
povr{ine prizme uronjene u rastvor), koje se mogu pro~itati na ska-
lama, budu jednake: b
s
= 15.
Ogledalo podesiti tako da levo i desno polje u okularu budu
maksimalno osvetljeni. Nagib ogledala ne sme se menjati do kraja
eksperimenta.
Ako polja u okularu nisu podjednako osvetljena, pomerati desnu
prizmu sve dok se polja ne izjedna~e. Kalibracija se vr{i tako {to se
specijalnim zavrtnjem podesi desna skala kako bi debljina sloja po-
novo pokazivala vrednost b
s
= 15.
Merenje
Desnu kivetu isprati i napuniti rastvorom nepoznate koncentracije,
a zatim prizmu pomerati dok se intenziteti oba polja ne izjedna~e.
Debljinu sloja b
x
pro~itati na nonijusu, pomeriti prizmu u krajnji
gornji polo`aj, ponovo izjedna~iti intenzitete polja u okularu i pro-
~itati vrednost b
x
. Ova merenja ponoviti deset puta.
Levu kivetu sa standardnim rastvorom postaviti tako da debljina
sloja kroz koju svetlost prolazi bude b
s
= 10 i, na ve} opisan na~in,
izvr{iti deset merenja za b
x
.
Rezultate prikazati tabelarno.
NAPOMENA:
Prizme postaviti u krajnji gornji polo`aj prilikom
postavljanja i menjanja kiveta, da ne bi do{lo do o{te}ivanja prizmi.
Medenica / Male{ev
82

85
Eksperimentalna fizi~ka hemija
Fotometrija
je metoda za odre|ivanje koncentracije obojenih rast-
vora. Zasniva se na neposrednom merenju intenziteta propu{tene
svetlosti I
p
kroz analizirani rastvor, iz koga se izra~unava koncen-
tracija pomo}u Lamber-Berovog zakona:
gde je:
a – apsorpcioni koeficijent koji predstavlja apsorpcionu mo} sup-
stancije na datoj talasnoj du`ini
b – du`ina svetlosnog puta kroz rastvor
c – koncentracija analiziranog rastvora
I
0
– intenzitet upadne svetlosti
I
p
– intenzitet propu{tene svetlosti.
Jedan od na~ina odre|ivanja koncentracije analiziranog rastvora
sastoji se u tome da se izmeri intenzitet propu{tene svetlosti I
p
, pri
~emu je intenzitet upadne svetlosti pode{en na 100%. Pomo}u jed-
na~ine (1) izra~unava se koncentracija
c
:
Vrednost apsorpcionog koeficijenta
a
odre|uje se, tako|e, iz jed-
na~ine (2), merenjem intenziteta svetlosti propu{tene kroz isti rast-
vor poznate koncentracije.
Naj~e{}e primenjivana metoda za odre|ivanje koncentracije
rastvora je
metoda standarda
. Kod ove metode nije potrebno znati
vrednost apsorpcionog koeficijenta. Prema Lamber-Berovom zako-
nu za rastvor poznate koncentracije va`i:
FOTOMETRIJA
(gr~ki
fotos
– svetlost i
metria
– merenje)
Teorijski princip
I
0
I
p
(1)
=
a . b . c
A =
log
I
0
I
p
(2)
c =
log
1
a . b
(3)
A
s
= a . b . c
s
86
a za isti rastvor nepoznate koncentracije:
gde je proizvod
ab
isti za oba rastvora.
Deljenjem prethodnih jedna~ina dobija se izraz za izra~unavanje
nepoznate koncentracije:
Kod primene metode standarda treba voditi ra~una da koncen-
tracije standardnog i analiziranog rastvora budu dovoljno bliske,
tako da linearna zavisnost A = f(c) va`i u intervalu ovih koncentra-
cija (str 95).
Instrumenti kojima se meri intenzitet zra~enja, propu{tenog
kroz analizirani rastvor, nazivaju se
fotometri
ili
fotoelektri~ni ko-
lorimetri
. Na slici 1 prikazana je opti~ka shema fotoelektri~nog ko-
lorimetra s jednom foto}elijom. Pored ovih postoje i fotometri sa
dve foto}elije, odnosno sa dva odvojena svetlosna snopa, ~ime se eli-
mini{u gre{ke koje bi mogle nastati usled promene intenziteta svet-
losnog izvora.
Izvor polihromatske svetlosti (volframova sijalica) emituje belu
svetlost koja se, prolaskom kroz kolimatorsko so~ivo, usmerava u
paralelnim snopovima na monohromator. Kod fotometara, mono-
hromatori su selektivni apsorpcioni filtri koji propu{taju spektralne
trake talasnih du`ina u opsegu od 30 do 50 nm. To su obi~no poli-
Medenica / Male{ev
A
x
A
s
c
x
= c
s
(5)
(4)
A
x
= a . b . c
x
Slika 1.
Opti~ka shema
fotoelektri~nog kolorimetra
W – volframova sijalica
S – kolimatorsko so~ivo
F – filtar
K – odeljak za kivete (A – analizirani
rastvor, S – slepa proba)
D – detektor
P – potenciometar
A – miliampermetar

bancije (A), tako {to se 100% T poklapa sa A = 0. Po{to je T = I
p
/I
0
,
za transparenciju u procentima va`i:
Cela skala u T% mo`e se podesiti tako da bude jednaka intenzite-
tu upadne svetlosti I
0
. Po{to je skala podeljena na 100 jednakih delo-
va, va`i jednakost I
0
= 100. Zamenom u jedna~inu (6), dobija se da
je T% = I
p
. Prema tome, na skali se mo`e istovremeno pro~itati
vrednost T%, odnosno I
p
i odgovaraju}a apsorbancija, koja se izra-
~unava iz izraza:
Merenja se vr{e tako {to se svetlost prvo propu{ta kroz kivetu sa
rastvara~em, koji se naziva slepa proba. Igla instrumenta zauze}e ne-
ki polo`aj na skali. Pomo}u odgovaraju}eg potenciometra podesi se
igla na 100% T, odnosno na A = 0, ~ime se kompenzuje apsorpcija
koja poti~e od kivete i rastvara~a.
Propu{tanjem svetlosti kroz kivetu sa analiziranim rastvorom,
igla }e se zaustaviti na vrednosti apsorbancije, koja je srazmerna
koncentraciji rastvorka.
Iz izmerenih vrednosti apsorbancija standardnog i analiziranog
rastvora
A
s
i
A
x
i poznate koncentracije standardnog rastvora
c
s
,
prema jedna~ini (5) izra~unava se koncentracija rastvora
c
x
.
Fotometrija je na{la {iroku primenu u svim analiti~kim labora-
torijama, naro~ito biohemijskim, koje imaju veliki broj oficinalnih
postupaka kvantitativne apsorpcione fotometrije pri odre|ivanju
mnogih parametara va`nih u biohemiji.
Medenica / Male{ev
88
I
p
I
0
T% =
. 100
(6)
100
I
p
A =
log
(7)
Aparatura i hemikalije
l
Fotometar MA 9507 I
SKRA
– Kranj (slika 3)
l
Obojeni rastvor poznate i nepoznate koncentracije
URADITE SAMOSTALNO ...
Odre|ivanje
koncentracije
obojenog rastvora
Zadatak eksperimenta
n
Izvr{iti po pet merenja apsorbancija A i intenziteta propu{tene
svetlosti I za rastvore poznate i nepoznate koncentracije.
Iz srednjih vrednosti izra~unati procentnu koncentraciju rastvora,
posebno preko pro~itane i izra~unate vrednosti apsorbancija.
Slika 3.
Fotometar MA 9507 I
SKRA
– Kranj
1 – zavrtanj za korekciju mehani~kog
nultog polo`aja kazaljke
2 – mre`ni prekida~
3 – preklopnik
PRIPRAVA
-
MERITEV
(priprema-merenje)
4 – indikatorsko svetlo
5 – filtar u opti~kom sistemu
6 – kiveta u opti~kom sistemu
7 – potenciometar grube regulacije A = 0
8 – potenciometar fine regulacije A = 0
9 – filtri u spremi{tu
10 – stalak za kivete
1
2
5
6
9
10
3
7
8
4
Eksperimentalna fizi~ka hemija
89
Priprema
Prema boji analiziranog rastvora izabrati odgovaraju}i filtar kom-
plementarne boje (tablica 1, str 87) i postaviti u opti~ki sistem.

Eksperimentalna fizi~ka hemija
91
M
ERENJE
1
2
3
4
5
S
TANDARD
(c = ..... %)
A
s
I
s
(%)
A
NALIZIRANI RASTVOR
c
x
(%)
A
x
I
x
(%)
< n >
Tabela 1.
Rezultati merenja apsorbancije i transparencije
REZULTATI
Tabela 2.
Rezultati izra~unavanja koncentracije
M
ERENJEM APSORBANCIJE
M
ERENJEM TRANSPARENCIJE
< A
s
>
< A
x
>
c
x
(%)
< I
s
>
< I
x
>
< A
s
>
< A
x
>
c
x
(%)
Eksperimentalna fizi~ka hemija
93
Spektrofotometrija
je metoda koja izu~ava apsorpciju ta~no defini-
sanog monohromatskog zra~enja dobijenog specijalnim prizmama
ili re{etkama. Apsorbovano zra~enje prouzrokuje energetske pro-
mene u molekulu. Od ukupne koli~ine zra~enja supstancija apsor-
buje samo one frekvencije, odnosno onu energiju zra~enja koja mo-
`e izazvati energetske promene stanja u atomu ili molekulu date
supstancije. Na slici 1 prikazana je podela elektromagnetskog zra-
~enja, uz prikaz talasnih du`ina, odnosno frekvencija, a u tabeli 1 i
dejstvo zra~enja na molekul.
Tip zra~enja
Talasna du`ina
Dejstvo zra~enja
γ
zraci
100 fm – 100 pm
jonizacija
χ
zraci
6 pm – 100 nm
jonizacija
UV
100 – 390 nm
pobu|ivanje elektrona
VIS
390 – 800 nm
pobu|ivanje elektrona
IR
800 nm – 200
µ
m
pobu|ivanje oscilacija
mikrotalasi
200
µ
m – 10 cm
pobu|ivanje rotacija
radiotalasi
> 10 cm
pobu|ivanje rotacija
Apsorpcija zra~enja u ultraljubi~astoj (UV) i vidljivoj (VIS) ob-
lasti izaziva pobu|ivanje (ekscitaciju) elektrona, pa se
UV/VIS ap-
sorpciona spektroskopija
naziva jo{ i
elektronska spektroskopija
.
Ovom metodom prou~avaju se spektri supstancija u molekulskom
stanju, pa se na osnovu analize spektra mogu protuma~iti i struktu-
re molekula.
Nosioci apsorpcije u molekulu su male atomske grupe, tzv.
hro-
mofore
. Apsorpcija hromofora poti~e od elektronskih prelaza sa os-
novnog na vi{i nivo (n
Õ
σ
*, n
Õ
π
*,
π
Õ
π
*), koji se de{avaju zbog
apsorpcije odre|enih frekvencija zra~enja. U tabeli 2 prikazane su
neke hromofore i odgovaraju}e vrednosti talasnih du`ina pri kojima
se de{avaju elektronski prelazi.
SPEKTROFOTOMETRIJA
Teorijski princip
Slika 1.
Podela elektromagnetskog zra~enja
Tabela 1.
Elektromagnetsko zra~enje

Kvantitativna analiza se zasniva na Lamber-Berovom zakonu. Za
izra~unavanje koncentracije analiziranog rastvora naj~e{}e se koristi
metoda kalibracione krive
.
Merenje apsorbancije vr{i se na talasnoj du`ini na kojoj anali-
zirani rastvor najvi{e apsorbuje (ili nekoj drugoj optimalnoj talasnoj
du`ini), ~ime se posti`e najve}a osetljivost metode, koja je data ko-
eficijentom
∆
A/
∆
c. Za niz rastvora poznatih koncentracija izmere se
apsorbancije na talasnoj du`ini
λ
max
i konstrui{e dijagram A = f(c)
(slika 3). Iz izmerene apsorbancije
A
x
za rastvor nepoznate koncen-
tracije, sa kalibracione krive se grafi~kim putem odredi
c
x
, kako je
ozna~eno na slici 3.
Za merenje apsorpcionih spektara koriste se opti~ki instrumenti
–
spektrofotometri
(slika 4).
Eksperimentalna fizi~ka hemija
95
Slika 3.
Kalibraciona kriva
A
x
– apsorbancija rastvora nepoznate
koncentracije
c
x
– nepoznata koncentracija
Slika 4.
Shema jednokanalnog spektrofotometra
L – izvor kontinualnog zra~enja
S – kolimatorsko so~ivo
UR – ulazni razrez
M – monohromator
IR – izlazni razrez
K – kiveta sa rastvorom
F – fotodetektor
R – ure|aj za merenje i registrovanje
fotostruje
Osnovni delovi spektrofotometra su:
q
Izvor svetlosti
q
Monohromator
q
Fotodetektor
Kod apsorpcione spektrofotometrije koriste se
izvori
sa kontinu-
alnim zra~enjem. Postoje dva tipa ovih izvora zra~enja:
1. termi~ki
2. izvori sa elektri~nim pra`njenjem.
Termi~ke izvore zra~enja
predstavljaju lampe sa vlaknom, odnos-
no zagrevnom niti ili spiralom od nekog te{ko topivog metala, npr.
volframa ili njegove legure. Ovi izvori koriste se za vidljivu, blisku
ultraljubi~astu i blisku infracrvenu oblast spektra, odnosno u oblasti
talasnih du`ina od 350 do 1000 nm. Kako se volframovo vlakno vre-
menom oksidi{e, to mo`e do}i do promene spektralne raspodele
emitovane svetlosti, o ~emu se mora voditi ra~una tokom spektrofo-
tometrijskih merenja. Kod savremenijih instrumenata danas se sve
vi{e koristi kvarc-jodna lampa u oblasti od 300 do 1000 nm.
Izvore sa elektri~nim pra`njenjem
predstavljaju vodoni~na i deu-
terijumova lampa. To su kvarcne cevi napunjene vodonikom ili deu-
terijumom, u kojima se vr{i elektri~no pra`njenje. Primenjuju se u
opsegu talasnih du`ina od 160 do 380 nm.
Monohromatori
su opti~ki delovi spektrofotometra koji izdvajaju
monohromatsku svetlost, odnosno svetlost odre|ene, ta~no defini-
sane talasne du`ine. Kao monohromatori naj~e{}e se koriste
opti~ke
prizme
i
difrakcione re{etke
. Svetlosni zrak se prelama na grani~nim
povr{inama prizme i prolaze}i kroz prizmu menja svoj pravac. Izlaz-
ni ugao svetlosnog zraka ima razli~ite vrednosti za razli~ite talasne
du`ine. U vidljivoj oblasti mogu se koristiti prizme od opti~kog
stakla, jer ne apsorbuju vidljivu oblast spektra. U UV oblasti se ko-
riste samo prizme od kvarca, jer prizme od opti~kog stakla apsorbu-
ju UV zra~enje.
Difrakcione re{etke su staklene plo~ice na kojima su urezane lini-
je (otvori) na podjednakom rastojanju jedna od druge. Na mestima
ureza dolazi do difrakcije svetlosnog snopa. Zraci ve}e talasne du-
`ine imaju ve}i ugao skretanja. Nedostatak difrakcionih re{etki je u
tome {to daju spektre vi{eg reda, odnosno monohromatski zrak sa-
dr`i i strane talasne du`ine.
Medenica / Male{ev
96

oblasti. Ova foto}elija nije pogodna za rad sa malim intenzitetima
svetlosti, jer se dobija mali intenzitet fotostruje, a time i mala oset-
ljivost metode za odre|ivanje koncentracije.
Fotomultiplikator
je ure|aj za merenje malih intenziteta svet-
losti. Koristi se da bi se poja~ao signal, odnosno intenzitet primarne
fotostruje (slika 7).
Fotoni upadne svetlosti koji padaju na katodu izbijaju elektrone,
koji se usmeravaju ka anodi. Zbog postojanja elektri~nog polja, elek-
troni dobijaju veliku kineti~ku energiju, pa iz susedne elektrode (di-
node) izbijaju vi{e novih elektrona. Pomenuti proces ponavlja se u
zavisnosti od broja postavljenih dinoda i ja~ine elektri~nog polja. Na
ovaj na~in primarna fotostruja mo`e se uve}ati i sto hiljada puta.
U spektrofotometru se nalaze dve foto}elije (crvena i plava), a iz-
bor zavisi od dela spektra u kome se vr{e merenja. Karakteristi~na
veli~ina je tzv.
ta~ka prelaza
, koja predstavlja talasnu du`inu na ko-
Medenica / Male{ev
98
Slika 6.
Vakuumska foto}elija
Slika 7.
Fotomultiplikator
A – anoda
K – katoda
D – dinoda
Eksperimentalna fizi~ka hemija
99
joj obe foto}elije pokazuju istu osetljivost, odnosno istu apsorbanci-
ju. Ona se obi~no nalazi na oko 625 nm i povremeno se mora kon-
trolisati.
Opti~ki deo spektrofotometra
~ine kolimatorsko so~ivo, razrez,
ogledala i kivete. Opti~ki sistem slu`i da usmeri svetlosne zrake kroz
spektrofotometar, kao i da smanji gubitak (rasejanje) svetlosnog
zraka.
Kolimatorsko so~ivo
slu`i da svetlost, koja se pri prolasku kroz
ulazni razrez prostire na sve strane, usmeri u paralelnom snopu ka
monohromatoru.
Ulazni razrez
ima ulogu da bude predmet, ~iji se
monohromatski lik formira u ravni izlaznog razreza. [irinom
izlaz-
nog razreza
odre|uje se interval talasnih du`ina svetlosti u kome se
nalazi svetlosni talas koji izlazi iz monohromatora.
Staklene kivete
se
koriste samo u vidljivom delu spektra, jer apsorbuju UV zra~enje, a
kvarcne mogu i u vidljivoj i UV oblasti spektra.
Osim jednokanalnih, postoje i dvokanalni spektrofotometri ~ija
je prednost u istovremenom merenju slepe probe i analiziranog rast-
vora, ~ime se izbegava promena intenziteta upadnog zra~enja, koja
mo`e nastati izme|u pojedina~nog merenja slepe probe i uzorka.

Apsorpcioni spektar (spektrofotogram)
U odre|enom opsegu talasnih du`ina izmeriti apsorbancije jednog
od pripremljenih rastvora (npr. rastvora najve}e koncentracije) i na-
crtati apsorpcioni spektar (slika 2). Talasna du`ina na kojoj rastvor
najvi{e apsorbuje obele`ava se sa
λ
max
. Merenjem apsorbancija na
ovoj talasnoj du`ini posti`e se najve}a osetljivost metode.
Merenja vr{iti na polo`aju
blue
(plava foto}elija) sa pomakom
od 10 nm.
Konstruisanje kalibracione krive
Izmeriti apsorbancije svih {est pripremljenih rastvora poznatih
koncentracija na
λ
max
. Kivetu prethodno isprati rastvorom ~ija se
apsorbancija meri, da ne bi do{lo do promene koncentracije.
Konstruisati dijagram funkcije A = f(c) (slika 3), u kome sve ta~-
ke treba da le`e na pravoj koja je definisana Lamber-Berovim zako-
nom. Ova
kalibraciona kriva
slu`i za odre|ivanje koncentracije
rastvora grafi~kim putem.
Odre|ivanje nepoznate koncentracije
Za rastvor nepoznate koncentracije
c
x
izmeriti apsorbanciju na
λ
max
.
Koncentraciju odrediti grafi~kim putem, kao {to je prikazano na
slici 3.
Rezultate prikazati tabelarno i grafi~ki.
NAPOMENA:
Pri konstruisanju kalibracione krive voditi ra~una da
numeri~ku podelu apsorbancije i koncentracije treba po~eti od
»nule«, kao {to je predstavljeno na slici 3.
Eksperimentalna fizi~ka hemija
101
Medenica / Male{ev
102
REZULTATI
Tabela 1.
Priprema rastvora
Tabela 2.
Apsorpcioni spektar
c
2
(%)
V
1
(mL)
Tabela 3.
Kalibraciona kriva
c (%)
A
Tabela 4.
Grafi~ko odre|ivanje nepoznate koncentracije
A
x
c
x
(%)
λ
(nm)
A
λ
max
= ...... nm
λ
max
= ...... nm
c
1
= .......%
V
2
= 25 mL

Medenica / Male{ev
104
Uklju~ivanje aparata
Uklju~iti aparat u struju preko stabilizatora napona.
Okrenuti glavni preklopnik (5) sa leve strane mernog instru-
menta sa polo`aja
of
(isklju~eno) na
zero
(nula) i pri~ekati 10 mi-
nuta da se lampa zagreje i stabilizuje.
Priprema za merenje
Izvaditi nosa~ kiveta (3) i u polo`aj »1« staviti kivetu sa rastvara~em
– slepa proba (destilovana voda), a u polo`aj »2« kivetu sa rastvorom.
Nosa~ vratiti tako da se bela strelica poklopi sa brojem »1« na pok-
lopcu nosa~a (svetlosni snop tada prolazi kroz rastvara~). Postaviti
radnu talasnu du`inu (6) i izabrati odgovaraju}u talasnu du`inu (4).
Slika 9.
Opti~ka shema spektrofotometra
Unicam
SP 600
1 – izvor svetlosti (volframova lampa)
2 – ogledalo
3 – otvor (slit)
4 – monohromator (staklena prizma)
5 – kivete
6 – zastor foto}elija
7 – plava foto}elija
8 – crvena foto}elija
Eksperimentalna fizi~ka hemija
105
Merenje
a) Pode{avanje elektri~ne nule:
pri polo`aju glavnog preklopnika
na
zero
, potenciometrom (7) sa oznakom
zero
podesiti iglu mer-
nog instrumenta (10) na sredinu skale (nula skale). Ovim se elimi-
ni{e
tamna struja
koja poti~e od tzv. »lutaju}ih elektrona« u foto}eli-
ji, a koja nije posledica osvetljenosti foto}elije.
b) Pode{avanje nule instrumenta:
pri unapred izabranoj talasnoj
du`ini
vawelength
, glavni preklopnik okrenuti sa
zero
na »100%«
i regulatorom (8) sa oznakom
slit width
({irina otvora) podesiti
{irinu otvora kroz koji prolazi svetlost, tako da se igla mernog in-
strumenta ponovo vrati na nulu. Na ovaj na~in elimini{e se apsor-
bancija slepe probe, odnosno rastvara~a i kivete na talasnoj du`ini
merenja apsorbancije rastvora.
c) O~itavanje apsorbancije:
poklopac nosa~a kiveta pomeriti u po-
lo`aj »2« (svetlost prolazi kroz ispitivani rastvor), a glavni preklopnik
postaviti na
test
(uzorak). Potenciometrom iznad skale sa ozna-
kom
absorbance
(apsorbancija) (9) ponovo podesiti iglu mernog
instrumenta na nulu. Preklopnik
vratiti
na
zero
i pro~itati vrednost
apsorbancije na donjoj skali. Vrednosti na gornjoj skali predstavljaju
transparentnost, tj. propu{tenu svetlost.
Operacije pod a), b) i c) ponavljati za svaku narednu talasnu du-
`inu, s tim {to se pode{avanje elektri~ne nule ne mora vr{iti ako je
napon napajanja stabilan.
PA@NJA:
1. Proveriti da li je glavni preklopnik vra}en sa polo`aja
test
na
polo`aj
zero
u toku o~itavanja vrednosti apsorbancija.
2
.
Za talasne du`ine
λ
< 400 nm koristiti filtar br. 2, a za
λ
> 400 nm
filtar br. 1.
3
.
Za talasne du`ine
λ
< 625 nm koristiti plavu, a za
λ
> 625 nm
crvenu foto}eliju.

Eksperimentalna fizi~ka hemija
109
Elektroliza
je proces razlaganja elektrolita pod uticajem jednosmer-
ne struje. Propu{tanjem jednosmerne struje kroz elektrolit dolazi do
ure|enog kretanja jona (slika 1).
Katjoni
se kre}u ka katodi
K
na ko-
joj se redukuju:
K
n+
+ ne
–
Õ
K
Anjoni
se na anodi
A
oksidi{u predaju}i svoje elektrone anodi:
A
n–
Õ
A + ne
–
Prou~avanjem procesa elektrolize bavio se Faradej (Faraday), ko-
ji je definisao dva osnovna zakona.
Prvi Faradejev zakon.
Masa izdvojene supstancije na elektro-
dama srazmerna je koli~ini propu{tenog elektriciteta:
gde propu{tena koli~ina struje predstavlja proizvod ja~ine struje
I
(A) i vremena prolaska struje kroz rastvor
t
(s):
Izdvojena masa ne zavisi od temperature, gustine struje na elektro-
dama, oblika elektroda i suda u kome se izvodi elektroliza.
Drugi Faradejev zakon.
Pri prolasku iste koli~ine struje kroz ra-
zli~ite rastvore elektrolita, na elektrodama se izdvajaju ekvivalentne
mase supstancija, odnosno one stoje u odnosu svojih hemijskih ek-
vivalenata.
Jedinice koli~ine elektriciteta su:
kulon
(C) i
faradej
(F = 9,65×10
4
C mol
-1
). Kulon u jedinici vre-
mena prenese ja~inu struje od 1A.
ELEKTROLIZA
Teorijski princip
Slika 1.
Kretanje jona pod dejstvom
jednosmerne struje
(
l
– katjoni,
l
l
– anjoni)
m
∝
Q
(1)
Q = I . t Q (=) A . s
(2)
Faradej je koli~ina elektriciteta koja na elektrodama izvr{i hemij-
sku izmenu jednog mola nekog jednovalentnog elementa, ili u slu-
~aju vi{evalentnih, jednog ekvivalenta. Ovde je neophodno defini-
sati
hemijski ekvivalent
nekog elementa (iako SI ne prikazuje ovu
veli~inu), odnosno ekvivalentnu masu, koja predstavlja koli~nik
atomske mase i broja elektrona izmenjenih u toku elektrolize. To
zna~i da }e se pri prolasku struje od 1F uvek izdvojiti 108 g Ag, a
bakra dva puta manje od atomske mase bakra, jer je ekvivalentna
masa Cu = atomska masa Cu / 2.
Prema definiciji, ako koli~ina elektriciteta od jednog faradeja iz-
dvoji jedan ekvivalent supstancije, onda }e koli~ina elektriciteta
Q
izdvojiti
m
kilograma tog elementa:
Iz definicije za ekvivalentnu masu mo`e se napisati:
Zamenom jedna~ine (4) u jedna~inu (3) i re{avanjem po
m
, do-
bija se matemati~ki izraz drugog Faradejevog zakona:
gde je:
M – molarna masa (kg mol
-1
)
z – broj elektrona izmenjenih elektrolizom.
Koli~nik M/z F naziva se
elektrohemijski ekvivalent e
. Pred-
stavlja konstantu proporcionalnosti izme|u mase i koli~ine elektri-
citeta, a zavisi od prirode supstancije koja reaguje na elektrodama.
To je masa supstancije u kg, koju izdvaja 1C.
Uvo|enjem elektrohemijskog ekvivalenta
e
u jedna~inu (5) do-
bija se izraz za izra~unavanje mase izdvojene supstancije u toku
elektrolize:
Medenica / Male{ev
110
1
F
: 1
eq = Q
:
m
(3)
eq =
M
z
(4)
m =
Q
F
M
z
(5)
.
m = e . Q
(6)

Elektrode su uronjene u elektrolit koji se sastoji od vodenog rast-
vora bakar(II)-sulfata kome je dodata mala koli~ina sulfatne kiseline
i izvesna koli~ina etanola. Sulfatna kiselina suzbija hidroliti~ko de-
jstvo vode na bakar(II)-sulfat i pojavu bakar(I)-jona, nastalih ne-
potpunom redukcijom bakar(II)-jona na katodi. Etanol spre~ava
oksidaciju ve} nastalog bakra.
Maksimalna ja~ina struje koja prolazi kroz elektrolit u toku elek-
trolize izra~unava se iz izraza:
gde je:
P – povr{ina uronjenog dela elektrode
j – gustina struje (j = I/P).
Povr{ina elektrode mno`i se sa 2, jer se bakar talo`i na obe strane
elektrode.
Optimalna gustina struje za bakrov kulometar je j = 0,01 – 0,02 A
cm
-2
, jer se pri tim uslovima dobija najkompaktniji sloj istalo`enog
bakra.
Postoje razli~ite vrste kulometara (bakrov, srebrov, jodni, gasni),
prema elementima koji se u kulometrima elektrolizom izdvajaju –
talo`e ili osloba|aju.
Elektri~na shema za izvo|enje elektrolize prikazana je na slici 3.
Propu{tanjem jednosmerne struje kroz bakrov kulometar, na
elektrodama se de{avaju slede}e elektrohemijske reakcije:
Anoda:
Cu
Õ
Cu
2+
+ 2e
–
Katoda:
Cu
2+
+ 2e
–
Õ
Cu
Zna~i da se anoda rastvara, a na katodi dolazi do talo`enja ele-
mentarnog bakra. Prema tome, na osnovu mase istalo`enog bakra
pri ta~no definisanim uslovima elektrolize (
I
,
j
,
t
) mo`e se proveriti
Faradejev zakon elektrolize.
Medenica / Male{ev
112
Slika 3.
Elektri~na shema
za izvo|enje elektrolize
S – izvor jednosmerne struje
R – promenljivi otpor
K – kulometar
P – prekida~
A – ampermetar
I =
2
P . j
(8)
Aparatura
l
Bakrov kulometar (slika 2)
l
Akumulator
l
Ampermetar
l
Promenljivi otpornik
l
Prekida~
l
Hronometar
l
Etanol
Priprema
Izmeriti povr{inu uronjenog dela bakarne plo~e (katode).
Izra~unati ja~inu struje (
I
) i vreme (
t
), koji su potrebni da se ista-
lo`i zadata masa bakra (
m
), kada je gustina struje j = 0,01 A cm
-2
(e = 0,3294 mg C
-1
).
Bakarnu katodu o~istiti {mirgl-papirom ili razbla`enom nitrat-
nom kiselinom, oprati destilovanom vodom, zatim etanolom i osu-
{iti. Izmeriti masu katode na analiti~koj vagi sa ta~no{}u ~etiri deci-
malna mesta (masa m
1
).
Postupak
Prema shemi za elektrolizu (slika 3), spojiti sve elemente aparature.
U momentu uklju~ivanja kola struje uklju~iti hronometar i ot-
pornikom podesiti ja~inu struje na izra~unatu vrednost
I
. U toku
elektrolize odr`avati konstantnu ja~inu struje pomo}u otpornika.
Nakon izvr{ene elektrolize (po isteku vremena
t
) izvaditi katodu iz
kulometra, preliti je destilovanom vodom, zatim etanolom, osu{iti i
izmeriti (masa m
2
). Na}i razliku m
2
– m
1
.
Radne uslove i rezultate merenja prikazati tabelarno.
Eksperimentalna fizi~ka hemija
113
URADITE SAMOSTALNO ...
Provera
Faradejevog zakona
Zadatak eksperimenta
n
Istalo`iti zadatu masu bakra i proveriti Faradejev zakon
elektrolize.

Eksperimentalna fizi~ka hemija
115
Kulometrijske metode
se zasnivaju na merenju koli~ine elektricite-
ta koja je protekla u toku elektrolize. Osnovni zahtev za sva kulo-
metrijska odre|ivanja je kvantitativna reakcija na elektrodama, uz
100%-tno iskori{}enje struje. To zna~i da se elektrodna reakcija odi-
grava kvantitativno u saglasnosti sa Faradejevim zakonima elek-
trolize, bez paralelnih sekundarnih reakcija. Struja elektrolize ne
sme se tro{iti na nekontrolisane, tj. konkurentne reakcije koje bi
ometale 100%-tno iskori{}enje struje.
Kulometrijska merenja mogu se izvoditi ili pri konstantnom po-
tencijalu ili pri konstantnoj ja~ini struje.
Kulometrija pri konstantnom potencijalu
zasniva se na elektrolizi
rastvora pri konstantnoj, unapred odabranoj, vrednosti potencijala
E
radne elektrode. Izbor potencijala radne elektrode vr{i se na os-
novu krive ja~ina struje – vreme za ispitivanu supstanciju (slika 1).
Pri konstantnoj vrednosti potencijala struja eksponencijalno
opada sa smanjenjem koncentracije supstancije:
gde je:
I
t
– ja~ina struje u vremenu t
I
0
– po~etna ja~ina struje
k – konstanta koja zavisi od prirode analizirane supstancije i eksperi-
mentalnih uslova.
Koli~ina elektriciteta proporcionalna je povr{ini ispod krive:
Kulometrija pri konstantnoj ja~ini struje
izvodi se uz odr`avanje
konstantne ja~ine struje. Koli~ina elektriciteta jednaka je proizvodu
ja~ine struje i vremena (slika 2):
Ova metoda koristi se kod kulometrijskih titracija.
KULOMETRIJSKA TITRACIJA
Teorijski princip
Slika 1.
Kriva ja~ina struje–vreme
pri E = const.
I
t
= I
0
. e
–k . t
(1)
Q = I . t
(3)
(2)
∫
t
0
Q
=
I
t
. dt
Kulometrijska titracija
doslovce zna~i »titracija kulonima«, tj.
»titracija strujom«. To zna~i da se iz izmerene koli~ine elektriciteta,
odnosno protekle konstantne ja~ine struje u toku vremena
t
trajanja
elektrolize, mo`e odrediti koncentracija analiziranog rastvora.
Prema na~inu izvo|enja, kulometrijske titracije mogu biti
nepo-
sredne
i
posredne
.
Kod neposredne kulometrijske titracije ispitivani elektrolit ne-
posredno reaguje na odgovaraju}oj elektrodi na ta~no definisani na-
~in. Kod ovih titracija, koje se izvode pri konstantnom potencijalu,
te{ko je na}i na~in odre|ivanja zavr{ne ta~ke titracije (Z.T.T.), pa se
retko koristi.
Posredna
kulometrijska titracija izvodi se tako {to se na jednoj
od elektroda, na ta~no poznat na~in, odvija elektrohemijski proces
uz 100%-tno iskori{}enje struje. Na toj elektrodi se elektroliti~kim
putem stvara titrant koji zatim kvantitativno reaguje sa analizira-
nom supstancijom, {to se mo`e prikazati na slede}i na~in:
A + ne
–
Õ
B
B + C
Õ
proizvod reakcije
gde je:
A – titrant prekursor (primarni titrant)
B – elektrogenerisani titrant
C – analizirani rastvor.
Medenica / Male{ev
116
Slika 2.
Grafi~ki prikaz funkcije Q = f(t)
kod kulometrije pri konstantnoj
ja~ini struje

hlorida ili kalijum-nitrata. Na taj na~in se spre~avaju reakcije izme-
|u proizvoda nastalih elektrohemijskim procesima na elektrodama.
Gre{ke u toku kulometrijskih merenja mogu nastati usled varija-
cija u struji ili ako se ne mogu precizno meriti ja~ina struje ili vreme.
Kulometrijska titracija mo`e se koristiti pri svim procesima neu-
tralizacije, talo`enja, oksidoredukcije i stvaranja kompleksa. Zbog
toga je ova elektrohemijska metoda na{la {iroku primenu u mnogim
farmaceutskim istra`ivanjima, naro~ito u ispitivanju i kontroli leko-
va, kao i u toksikolo{koj hemiji i biohemiji.
Prednost kulometrijske titracije le`i u jednostavnosti aparature,
kao i u velikoj preciznosti metode. Posebno je zna~ajno to {to se ti-
trant elektrogeneri{e, a to je veoma zna~ajno kod titranata koje je te-
{ko pripremiti, hemijski standardizovati i ~uvati zbog njihove nesta-
bilnosti. To zna~i da se na ovaj na~in mogu koristiti za titraciju i
veoma nestabilni titranti, npr. jod ili brom.
Karakteristi~an primer posredne titracije je odre|ivanje koncentra-
cije natrijum-tiosulfata sa jodom. Kako je jod veoma nestabilan i ne
mo`e se ta~no izvr{iti njegova standardizacija, to je kulometrijska
titracija idealna metoda za ovakve titracije. U anodni prostor sipa se
odre|ena zapremina natrijum-tiosulfata, kalijum-jodida i skroba. U
katodni prostor, koji je odvojen elektroliti~kim mostom od agar-aga-
ra, sipa se kalijum-hlorid kao elektrolit. U toku elektrolize se na ano-
di elektrogeneri{e elementarni jod oksidacijom iz kalijum-jodida:
2J
–
Õ
J
2
+ 2e
–
koji zatim reaguje sa natrijum-tiosulfatom:
2Na
2
S
2
O
3
+ J
2
Õ
Na
2
S
4
O
6
+ 2NaJ
Zavr{nu ta~ku titracije predstavlja pojava stabilne plave boje ra-
stvora nastale reakcijom skroba i joda koji se pojavio u vi{ku, jer je
sav natrijum-tiosulfat pre{ao u natrijum-tetrationat.
Medenica / Male{ev
118
Aparatura i hemikalije
l
Ure|aj za kulometrijsku titraciju (slika 3)
l
Mehani~ka me{alica
l
Hronometar
l
Natrijum-tiosulfat
l
Kalijum-jodid
l
Skrob
Priprema
Povezati aparaturu po shemi za izvo|enje kulometrijske titracije. U
anodni prostor (ve}a posuda) odmeriti 50 mL kalijum-jodida, 2 mL
skroba i zadatu zapreminu analiziranog rastvora natrijum-tiosulfa-
ta. U katodni prostor (manja posuda) sipati kalijum-hlorid. Donji
deo manje posude sa poroznim (sinterovanim) dnom prevu~enim
agar-agarom uroniti u rastvor ve}e posude, a zatim u obe staviti od-
govaraju}e elektrode. Anodu predstavlja platinska plo~ica, a katoda
mo`e biti i od bakra. Anodu treba uroniti tako da dr`a~ elektrode
bude van rastvora. Postaviti me{alicu u rastvor i pomo}u otpornika
podesiti brzinu okretanja me{alice tako da se ostvari mirno me{anje
rastvora.
Postupak
Istovremeno uklju~iti kolo struje preko prekida~a i hronometar, a
zatim ja~inu struje odr`avati konstantnom pomo}u promenljivog
otpora. Hronometar isklju~iti u trenutku kad se ceo rastvor oboji
Eksperimentalna fizi~ka hemija
119
U
UR
RA
AD
DIIT
TE
E S
SA
AM
MO
OS
ST
TA
AL
LN
NO
O ......
Odre|ivanje
koncentracije
natrijum-tiosulfata
Zadatak eksperimenta
n
Zadatu zapreminu natrijum-tiosulfata titrovati sa
elektrogenerisanim jodom pri odabranoj ja~ini struje. Titraciju
ponoviti tri puta. Iz vremena potrebnog za titraciju i ja~inu struje
izra~unati broj grama natrijum-tiosulfata za svaku titraciju
posebno. Iz srednje vrednosti broja grama < m > izra~unati mo-
larnu koncentraciju natrijum-tiosulfata.

Eksperimentalna fizi~ka hemija
V = ..........mL Na
2
S
2
O
3
e
Na
2
S
2
O
3
= 0,001638 g C
-1
121
REZULTATI
Tabela 1.
Eksperimentalni uslovi i rezultati titracije
T
ITRACIJA
I (A)
t (s)
m (g)
< m > (g)
c (mol L
–1
)
1
2
3
(7)
Potenciometrija
POTENCIOMETRIJSKA MERENJA
Odre|ivanje elektromotorne sile
Potenciometarsko odre|ivanje pH
Merenje pH rastvora pH-metrom
Jon-selektivne elektrode
POTENCIOMETRIJSKA TITRACIJA
Reakcija neutralizacije
Reakcija talo`enja
Potenciometrijska titracija po Pogendorfovoj metodi kompenzacije
Reakcija oksidoredukcije

Ako se cinkana i bakarna elektroda pove`u miliampermetrom,
igla instrumenta }e skrenuti, {to zna~i da je u }eliji do{lo do pojave
elektri~ne struje kao posledice oksidoredukcije. Ako se iz sistema ne
odvodi struja, javi}e se tzv.
ravnote`ni napon
, tj.
elektromotorna
sila
, koja predstavlja razliku potencijala elektroda:
Konvencijom Internacionalne unije za ~istu i primenjenu hemiju
(IUPAC), EMS galvanske }elije prikazuje se kao razlika potencijala
pozitivnije, desne elektrode (na kojoj se vr{i redukcija) i potencijala
negativnije, leve elektrode (na kojoj se vr{i oksidacija).
Potencijal elektrode
nastaje kao posledica stvaranja razlike nae-
lektrisanja izme|u metala i rastvora, odnosno na granici faza me-
tal/rastvor. Naziva se
ravnote`ni potencijal elektrode
, a zavisi od
prirode metala i koncentracije jona metala u rastvoru. Nastanak po-
tencijala elektrode je posledica stvaranja tzv.
dvostrukog elektri~-
nog sloja
na granici faza. Naime, kristalna re{etka metala sastoji se
od odgovaraju}ih jona i elektrona koji se haoti~no kre}u oko jona ~i-
ne}i tzv. »elektronski gas«. Kada se npr. bakarna {ipka uroni u rastvor
bakar(II)-sulfata, postoji te`nja da Cu
2+
joni sa bakarne {ipke pre|u
u rastvor. Posledica ovoga je da na metalu ostaju neneutralisani elek-
troni, pa elektroda postaje u izvesnoj meri negativna, a rastvor pozi-
tivan. Na dodiru faza metal/rastvor, uspostavlja se razlika potencijala
izme|u negativno naelektrisanog metala i pozitivno naelektrisanog
rastvora, kao posledica stvorenog dvostrukog elektri~nog sloja.
Osnovna jedna~ina teorije stvaranja elektrodnog potencijala je
Nernstova
(Nernst)
jedna~ina
za ravnote`ni potencijal elektrode:
gde je:
E0– standardni potencijal elektrode
R – gasna konstanta
T – temperatura
F – koli~ina struje od jednog faradeja (96.485 C mol
–1
)
n – broj elektrona po jonu koji se razmeni u redoks reakciji
a
ox
– aktivnost oksidovanog oblika metala
a
red
– aktivnost redukovanog oblika metala
Medenica / Male{ev
126
EMS
=
E
1
–
E
2
(1)
EMS
=
E
(+)
–
E
(–)
(2)
E
=
E
0
+
ln
RT
nF
a
ox
a
red
(3)
Prvi sabirak predstavlja
standardni potencijal E
0
, odnosno rav-
note`ni potencijal pri odnosu a
ox
/a
red
= 1 i zavisi od prirode sistema.
Standardni potencijali svih elektroda definisani su u odnosu na
standardni potencijal vodoni~ne elektrode, za koju je konvencijom
uzeto da ima potencijal jednak nuli (E
0
= 0,0000 V) na svim tempera-
turama, pri jedini~noj aktivnosti vodonikovih jona i parcijalnom
pritisku gasa vodonika od 1atm. Na taj na~in formirana je tablica
standardnih potencijala elektroda u kojoj se vodoni~na elektroda
nalazi oko sredine (tablica 7 u Prilogu).
Po{to je 2,303 RT/F = 0,0591 V, za T = 298,15 K (25°C), iz jed-
na~ine (3) sledi:
Jedna~ina (4) predstavlja Nernstov izraz za potencijal elektrode
bilo kog sistema. Za elektrodu I vrste, koju ~ini metal u rastvoru svo-
jih jona, jedna~ina (4) ima oblik:
jer je me|unarodnom konvencijom aktivnost metala definisana kao
jedinica, tj. a
red
= 1.
U izrazu za potencijal koristi se aktivnost jona
a
, data izrazom:
gde je
γ
– faktor aktivnosti, koji se izra~unava iz jonske ja~ine rastvo-
ra. Samo u slu~aju jako razbla`enih rastvora mo`e se aktivnost izjed-
na~iti sa koncentracijom.
Aktivnost analiziranih jona u rastvoru izra~unava se iz vrednosti
potencijala elektrode. U tu svrhu se indikatorska (merna) elektroda,
~iji potencijal zavisi od aktivnosti analiziranih jona, spre`e sa refer-
entnom (standardnom) elektrodom, ~iji je potencijal poznat i kon-
stantan i ne zavisi od aktivnosti analiziranih jona (slika 2). Potencijal
indikatorske elektrode (E
ind
) izra~unava se iz izraza za elektromo-
tornu silu sprega:
Eksperimentalna fizi~ka hemija
127
EMS
=
E
ind
–
E
ref
(7)
E
=
E
0 +
log
0,0591
n
a
ox
a
red
(4)
E
=
E
0 +
log
a
M
n+
0,0591
n
(5)
a
=
γ
×
c
(6)
Slika 2.
Galvanska }elija za odre|ivanje poten-
cijala elektrode

Na `ivinoj elektrodi dolazi do reverzibilne reakcije:
Hg
2
2+
+ 2e
–
2Hg
Prema konvenciji, koncentracija redukovanog oblika metala, od-
nosno koncentracija elementarne `ive i drugih ~vrstih supstancija,
jednaka je jedinici, pa prema op{tem Nernstovom izrazu (4) sledi
izraz za potencijal kalomelove elektrode:
Po{to je proizvod rastvorljivosti kalomela:
to se zamenom u jedna~inu (9) dobija:
odnosno:
gde zbir prva dva ~lana predstavlja standardni potencijal kalomelove
elektrode (E
0
kal
).
Kona~an izraz za potencijal kalomelove elektrode glasi:
odnosno:
U zavisnosti od koncentracije upotrebljenog kalijum-hlorida,
definisan je i potencijal kalomelove elektrode koji je konstantan i
reverzibilan, pa se ova elektroda koristi kao referentna. Naj~e{}e se
koriste zasi}ena (E = 0,2444 V), molarna (E = 0,2848 V) i 0,1 molar-
na (E = 0,3356 V, na 20°C) kalomelova elektroda.
Eksperimentalna fizi~ka hemija
129
E
Hg
2
2+
/Hg
=
E
0
Hg
2
2+
/Hg
+
ln
a
Hg
2
2+
RT
2
F
(9)
E
Hg
2
2+
/Hg
=
E
0
Hg
2
2+
/Hg
+
ln
RT
2
F
P
Hg
2
Cl
2
a
2
Cl
–
(11)
E
Hg
2
2+
/Hg
=
E
0
Hg
2
2+
/Hg
+
ln
P
Hg
2
Cl
2
–
ln
a
Cl
–
RT
2
F
RT
F
(12)
E
kal
=
E
0
kal
–
E
kal
=
E
0
kal
– 0,0591 log
a
Cl
–
ln
a
Cl
–
RT
F
(13)
(14)
P
Hg
2
Cl
2
= a
Hg
2
2+
.
a
2
Cl
–
(10)
Medenica / Male{ev
130
Potencijali svih elektroda definisani su u odnosu na
standardnu
vodoni~nu elektrodu
.
Vodoni~na elektroda
se sastoji od platinske plo~ice uronjene u
rastvor koji sadr`i vodonikove jone i oko kojih se kroz rastvor uvodi
~ist gas vodonik pod odre|enim pritiskom.
Op{ta formula ove elektrode jeste:
Pt
H
2
(g)
H
+
(aq)
Mehanizam uspostavljanja potencijala na platinskom provod-
niku sastoji se u uspostavljanju ravnote`e izme|u jona vodonika u
rastvoru i atomskog vodonika adsorbovanog na platini koja se po-
na{a kao »metalni« vodonik. Zato ova elektroda spada u elektrode
prve vrste. Na njoj se de{ava slede}a polureakcija:
H
2
Õ
2H
+
+ 2e
–
Potencijal elektrode dat je Nernstovim izrazom:
odnosno:
Kada je aktivnost vodoni~nih jona
a
H
+
jednaka jedinici (1 mol L
-1
H
2
SO
4
), a pritisak gasa vodonika jednak 1 atm, drugi sabirak u jed-
na~ini (16) jednak je nuli. Pod ovim uslovima vodoni~na elektroda
je uzeta kao
standardna
:
Prema me|unarodnoj konvenciji, standardni potencijal vodo-
ni~ne elektrode iznosi: E
0
= 0,0000 V. U odnosu na standardni po-
tencijal vodoni~ne elektrode dati su standardni potencijali drugih
elemenata i elektrodnih reakcija i prikazani u »naponskom nizu ele-
menata«.
Standardna vodoni~na elektroda prikazana je slede}om she-
mom:
Pt
H
2
(1atm)
H
+
(a
H
+
= 1,00)
Slika 4.
Vodoni~na elektroda
E
H
+
/
H
2
=
E
0
H
+
/
H
2
+
ln
RT
2F
a
2
H
+
a
H
2
(15)
E
H
+
/
H
2
=
E
0
H
+
/
H
2
+
E
H
+
/
H
2
=
E
0
H
+
/
H
2
ln
RT
F
a
H
+
a
H
2
(16)
(17)

Kada se izvr{i kompenzacija elektromotorne sile galvanskog
sprega EMS
x
, mo`e se napisati da je odnos sila EMS
a
i EMS
x
jednak
odnosu njihovih otpora, koji su srazmerni du`inama `ica
l
i
l
x
:
Umesto galvanskog sprega u sporedno kolo se uklju~i standardni
Vistonov
(Weaston)
element
koji ima poznatu i konstantnu elek-
tromotornu silu EMS
s
. Kada se kompenzacijom odredi odse~ak l
s
,
va`i}e slede}i odnos:
Deljenjem jedna~ine (2) sa jedna~inom (1) dobija se izraz:
iz koga se izra~unava elektromotorna sila galvanskog sprega
EMS
x
,
iz poznate vrednosti elektromotorne sile Vistonovog elementa.
Vistonov galvanski element (slika 2) koristi se kao standardni, jer
ima u toku du`eg vremena konstantnu EMS (EMS = 1,0183 V na
20°C) i mali temperaturni koeficijent elektromotorne sile. Koristi se
kao etalon za odre|ivanje EMS drugih galvanskih spregova.
Medenica / Male{ev
132
=
l
l
x
EMS
a
EMS
x
(1)
=
l
l
s
EMS
a
EMS
s
(2)
EMS
x
=
EMS
s
.
l
x
l
s
(3)
Slika 2.
Vistonov standardni element
Op{ta shema ovog sprega je:
Cd (Hg)
CdSO
4
(zasi}en)
Hg
2
SO
4
, Hg
Pozitivnu elektrodu ~ini `iva iznad koje se nalazi pasta `ive i `iva(I)-
sulfata u zasi}enom rastvoru kadmijum-sulfata. Na njoj se de{ava
redukcija, odnosno slede}a polureakcija:
Hg
2
2+
+ 2e
–
Õ
2Hg
Negativnu elektrodu ~ini kadmijum-amalgam u zasi}enom rastvoru
kadmijum-sulfata. Na njoj se de{ava oksidacija, odnosno slede}a
polureakcija:
Cd
Õ
Cd
2+
+ 2e
–
Nastajanje elektromotorne sile u Vistonovom galvanskom
spregu posledica je slede}e elektrohemijske reakcije:
Cd + Hg
2
2+
+ SO
4
2–
Õ
Cd
2+
+ 2Hg + SO
4
2–
sa elektromotornom silom koja je data jedna~inom:
gde je:
E
Hg
2
2+
/ 2Hg
– potencijal pozitivne `ivine elektrode
E
Cd
2+
/ Cd
– potencijal negativne kadmijumove elektrode.
Eksperimentalna fizi~ka hemija
133
E
= E
Hg
2
2+
/2Hg
–
E
Cd
2+
/Cd
(4)

Eksperimentalna fizi~ka hemija
135
REZULTATI
Tabela 1.
Odre|ivanje EMS
x
l
x
(mm)
l
s
(mm)
EMS
s
(V)
EMS
x
(V)
Eksperimentalna fizi~ka hemija
137
pH vrednost se defini{e kao negativan logaritam aktivnosti vodoni~-
nih jona u rastvoru:
Potenciometrijsko odre|ivanje pH zasniva se na merenju elek-
tromotorne sile galvanskog sprega metodom kompenzacije (slika 1,
strana 131). Galvanski spreg ~ine merna elektroda (reverzibilna na
aktivnost H
+
jona) i referentna elektroda koja ima poznat i konstan-
tan potencijal, nezavisan od aktivnosti H
+
jona. Kao merna elektro-
da naj~e{}e se koristi vodoni~na, hinhidronska ili staklena elektroda.
Galvanski spreg, koji ~ine hinhidronska i kalomelova elektroda,
predstavlja se slede}om usvojenom shemom:
Hinhidronska elektroda
je primer oksidoredukcione elektrode.
Sastoji se od platine uronjene u zasi}en rastvor hinhidrona, koji
predstavlja ekvimolarnu sme{u hinona i hidrohinona. U rastvoru se
de{ava reverzibilna reakcija izme|u hinona (Q) i njegovog reduko-
vanog oblika hidrohinona (H
2
Q):
Kako potencijal elektrode zavisi od aktivnosti jona u rastvoru (u
ovom slu~aju vodoni~nih jona), izraz za potencijal hinhidronske
elektrode glasi:
POTENCIOMETRIJSKO ODREIVANJE pH
Teorijski princip
pH = –
log
a
H
+
(1)
kalomelova
elektroda
elektroliti~ki
most
hinhidronska elektroda
sa ispitivanim rastvorom
hidrohinon
hinon
H
2
Q
Õ
Q +
2
H
+
2e
––

Iz izlo`enog sledi, da se merenjem elektromotorne sile galvan-
skog sprega hinhidronske i kalomelove elektrode mo`e izra~unati
pH analiziranog rastvora.
Hinhidronska elektroda je pogodna za upotrebu samo u jako
kiselim i neutralnim rastvorima, tj. do pH 8,0. To je zbog toga {to je
hidrohinon slaba kiselina, pa u alkalnim rastvorima primetno raste
protoliza, odnosno dolazi do promene odnosa koncentracija hinona
i hidrohinona. To uslovljava odstupanje od linearne zavisnosti:
E
hin
= f(pH)
Pogendorfova metoda kompenzacije koristi se za merenje elek-
tromotorne sile galvanskog sprega ~iji otpor nije veliki. Zato se ovaj
na~in potenciometrijskog odre|ivanja pH mo`e koristiti samo kod
spregova sa vodoni~nom ili hinhidronskom elektrodom.
Eksperimentalna fizi~ka hemija
139
Aparatura i hemikalije
l
Ure|aj za izvo|enje Pogendorfove metode kompenzacije (slika
1, strana 131)
l
Galvanski spreg nepoznate EMS
l
Vistonov standardni element
l
Platinska elektroda
l
Kalomelova elektroda
l
Hinhidron
l
Elektroliti~ki most od agar-agara
Priprema
U ~a{u sipati rastvor ~ija se pH vrednost odre|uje i dodati toliko
hinhidrona da rastvor bude zasi}en. Potrebna je mala koli~ina hin-
hidrona da bi se dobio zasi}en rastvor, {to se zapa`a plivanjem kri-
stali}a hinhidrona po povr{ini rastvora. Rastvor dobro prome{ati
staklenim {tapi}em i uroniti platinsku elektrodu, vode}i ra~una da
klema koja dr`i platinu ne do|e u kontakt sa rastvorom. Elektroli-
ti~kim mostom od agar-agara povezati hinhidronsku i kalomelovu
elektrodu. Tako je stvoren galvanski spreg ~iju vrednost elektromo-
torne sile treba odrediti.
Postupak
Izmeriti odse~ak kompenzacije
l
s
za Vistonov standardni element i
l
x
za pripremljeni galvanski spreg. Odrediti elektromotornu silu
EMS
x
na na~in opisan na strani 134 i izra~unati pH rastvora.
Rezultate prikazati tabelarno.
Medenica / Male{ev
140
URADITE SAMOSTALNO ...
Potenciometrijsko
odre|ivanje pH
Zadatak eksperimenta
n
Metodom kompenzacije odrediti elektromotornu silu
pripremljenog galvanskog sprega i izra~unati pH rastvora.

Eksperimentalna fizi~ka hemija
143
pH-metar je instrument za neposredno merenje pH rastvora. Gal-
vanski spreg, ~ija se elektromotorna sila meri (a pH vrednosti o~i-
tavaju na skali instrumenta), sastoji se od staklene i kalomelove elek-
trode uronjene u analizirani rastvor.
Staklena elektroda
, zbog velikog otpora, ne mo`e se koristiti kod
Pogendorfove metode kompenzacije. Me|utim, pH-metar je mili-
voltmetar sa veoma velikom unutra{njom otporno{}u tako da pri
merenju uzima iz sprega zanemarljivo male koli~ine struje. Staklena
elektroda je staklena cev na ~ijem se jednom kraju nalazi staklena
polulopta koja se pona{a kao jon-selektivna membrana za hidroni-
jum jone, {to zna~i da je omogu}eno prodiranje hidronijum jona u
kristalnu strukturu membrane (slika 1). U unutra{njosti se nalazi
tzv. unutra{nja referentna elektroda. To je elektroda druge vrste, sre-
bro/srebro-hloridna koja je uronjena u rastvor hloridne kiseline od-
re|ene aktivnosti hidronijum jona (0,1 mol L
–1
). Staklena elektroda
predstavlja se slede}om shemom:
Ag, AgCl
0,1 mol L
–1
HCl
staklena membrana
rastvor
Staklenu membranu ~ini posebno staklo u ~iji sastav pored Si
+4
ulaze i joni Na
+
, Ca
2+
, K
+
, »retkih zemalja« i dr. Na dodirnoj
povr{ini faza staklo/rastvor joni natrijuma zamenjuju se hidronijum
jonima. Tako nastaje membranski potencijal, {to ima za posledicu
promenu potencijala unutra{nje referentne elektrode, pri promeni
koncentracije hidronijum jona u rastvoru.
Potencijal staklene elektrode ~ini zbir potencijala unutra{nje refe-
rentne elektrode (E
UR
), potencijala unutra{nje povr{ine staklene
membrane (E
MU
) i potencijala spoljne povr{ine staklene membra-
ne (E
MS
). Ovom zbiru treba dodati i potencijal asimetrije (E
asim
), tj.
potencijal koji se javlja kao posledica neidenti~nosti spoljne i unu-
tra{nje povr{ine staklene membrane. Prema tome je:
Kako su za datu elektrodu prve tri vrste potencijala konstantne, a
E
MS
zavisi od koncentracije hidronijum jona u rastvoru, izraz za po-
tencijal elektrode je:
MERENJE pH RASTVORA pH-METROM
Teorijski princip
Slika 1.
Staklena elektroda
E = E
UR
+ E
MU
+ E
asim
+ E
MS
(1)
odnosno:
gde je E
K
= E
UR
+ E
MU
+ E
asim
= konst., za datu pojedina~nu elek-
trodu.
Asimetri~ni potencijal
nije konstantna vrednost za sve pojedi-
na~ne elektrode i nije isti za sve vrste staklenih elektroda. Predstavlja
merilo asimetrije staklene membrane u pogledu razli~itih osobina
dveju povr{ina membrane nastale u toku proizvodnje, usled nesa-
vr{enosti silikatne strukture. Mehani~ka i hemijska o{te}enja, kao i
kontaminacija u toku du`e upotrebe, tako|e uti~u na vrednost asi-
metri~nog potencijala. Efekat asimetri~nog potencijala na merenja
pH otklanja se povremenom kalibracijom elektrode sa jednim ili
vi{e standardnih pufera poznatih pH vrednosti.
Membranski potencijal na staklenoj elektrodi uspostavlja se pro-
cesom »potiskivanja«, pa je zato elektrodu pre upotrebe potrebno
aktivirati dr`anjem u rastvoru hloridne kiseline. Tada se i na spolja{-
njoj dodirnoj povr{ini faza staklo/rastvor izvr{i odgovaraju}a izme-
na jona natrijuma iz stakla sa hidronijum jonima iz rastvora. Posle
upotrebe elektroda se dr`i u destilovanoj vodi ili ve} kako proizvo-
|a~ savetuje u uputstvu.
Staklena elektroda mo`e pokazivati odstupanje membranskog po-
tencijala od pH vrednosti pri jako niskim vrednostima pH, a tako|e
i pri vrednostima pH>9, {to predstavlja tzv. »kiselu«, odnosno »al-
kalnu« gre{ku. Uzroci nastajanja nisu u potpunosti razja{njeni. Al-
kalna gre{ka mo`e se izbe}i primenom staklene elektrode koja ume-
sto Na
+
ili Ca
2+
jona sadr`i Li
+
ili Ba
2+
jon. Ova supstitucija pove}ava
opseg merenja elektrode. Do gre{aka u toku rada mo`e do}i i usled
»dehidratacije« elektrode koja nastaje posle dugotrajnog rada u
nevodenim sredinama ili ako se elektroda dr`i na suvom. U tom slu-
~aju potrebno je elektrodu ponovo aktivirati, a pri radu u nevode-
nim sredinama preporu~uje se povremeno dr`anje elektrode u vodi.
Gre{ke mogu nastati i pri merenju pH koloidnih rastvora, zatim
emulzija i suspenzija zbog indukovanog potencijala ovih naelek-
trisanih ~estica.
Nedostaci staklenih elektroda ogledaju se u visokoj otpornosti,
starenju membrane i pojavi potencijala asimetrije.
Medenica / Male{ev
144
E = E
K
+
ln
a
H
+
RT
F
(2)
E = E
K
–
0,0591
pH
(3)

pH-metri
su ure|aji koji se zasnivaju na radu cevnog milivolt-
metra koji su danas u potpunosti zamenjeni tranzistorskim mili-
voltmetrima. Iako opis cevnog milivoltmetra (slika 4) gubi na aktu-
elnosti, potrebno je objasniti princip rada, jer se primenjuje i na
na~in rada savremenih digitalnih instrumenata.
Cevni potenciometar se sastoji od triode, kod koje katoda
k
ima
sopstveno napajanje
B
k
. Kada se katoda zagreje, emituje elektrone
koji se kre}u ka anodi
a
. Ja~ina anodne struje, koja se meri na am-
permetru
A
, zavisi od napona koji je saop{ten katodi i anodi sa izvo-
ra jednosmerne struje
B
. Izme|u katode i anode postavljena je
mre`ica
M
kroz koju elektroni mogu nesmetano prolaziti ukoliko
nije vezana za neki galvanski spreg. Me|utim, ako se za mre`icu ve`e
galvanski spreg (za odre|ivanje pH rastvora) i mre`ica pove`e tako
da joj se saop{ti negativan potencijal, do}i }e do ko~enja elektrona.
To }e dovesti do smanjenja anodne struje. Ovo smanjenje srazmer-
no je elektromotornoj sili galvanskog sprega
EMS
x
, koja zavisi od
potencijala indikatorske elektrode, odnosno od pH rastvora. Skala
mernog instrumenta izra`ena je posebno u
mV
i
pH
jedinicama, {to
zna~i da se direktno mogu pro~itati i elektromotorna sila galvanskog
sprega i pH vrednost analiziranog rastvora. Na savremenim digital-
nim aparatima ova vrednost se o~itava na elektronskom prikaziva~u
– displeju.
Medenica / Male{ev
146
Slika 4.
Shema pH-metra
B – izvor jednosmerne struje
B
k
– izvor struje za katodu
EMS
x
– galvanski spreg
k – katoda
a – anoda
M – mre`ica
A – ampermetar
Eksperimentalna fizi~ka hemija
147
Aparatura i hemikalije
l
pH-metar MA 5740 I
SKRA
– Kranj (slike 5 i 6)
l
Kombinovana elektroda
l
Pufer
l
Analizirani rastvor
URADITE SAMOSTALNO ...
Merenje
p
H rastvora
p
H-metrom
Zadatak eksperimenta
n
Izmeriti pH rastvora pH-metrom.
Slika 5.
pH-metar MA 5740 I
SKRA
– Kranj

Pritiskom na tipku
pH
na prikaziva~u se javlja vrednost 0,000.
Ispisati vrednost pufera kojim se vr{i kalibracija, ~ime se otklanja
uticaj potencijala asimetrije i pritisnuti tipku
enter
. Na prikaziva~u
se javlja pribli`na vrednost pufera. Kada se broj stabilizuje, ponovo
pritisnuti
enter
. Ako je kalibracija zavr{ena, ~uje se zvu~ni signal
kao dug i kratak pisak. Gase se diode
cal
1 i pH. U protivnom, po-
javljuje se natpis
Err
i kodni broj gre{ke. Gre{ke se otklanjaju prema
uputstvu proizvo|a~a koje sadr`i spisak kodnih brojeva gre{aka.
Kalibracija u dve ta~ke
vr{i se pomo}u dva pufera, a izbor pufera
je takav da jedan pufer treba da ima manju pH vrednost, a drugi ve-
}u od o~ekivane pH vrednosti analiziranog rastvora. Kalibracija u
drugoj ta~ki mo`e se izvr{iti samo nakon izvr{ene kalibracije u prvoj
ta~ki.
Kombinovanu elektrodu spustiti u rastvor drugog pufera poz-
natog pH i pritisnuti
cal
2 (kalibracija u drugoj ta~ki) i
temp
. Na
prikaziva~u se javlja vrednost temperature od 25°C. Ako je potreb-
no, ispisati novu vrednost temperature prema temperaturi pufera i
pritisnuti tipku
enter
. Gasi se dioda
temp
.
Pritiskom na tipku
pH
na prikaziva~u se javlja vrednost prethod-
nog pufera kojim je vr{ena kalibracija u jednoj ta~ki. Ispisati novu
vrednost pufera kojim se vr{i kalibracija u drugoj ta~ki, a zatim pri-
tisnuti tipku
ENTER
. Na prikaziva~u se javlja pribli`na vrednost pufe-
ra. Kada se broj stabilizuje, ponovo pritisnuti
enter
. Ako je kalibra-
cija zavr{ena, ~uje se zvu~ni signal kao dug i kratak pisak. Gase se
diode
cal
1 i pH. U protivnom pojavljuje se natpis
Err
i kodni broj
gre{ke. Radi otklanjanja gre{ke postupa se prema uputstvu proizvo-
|a~a koje sadr`i spisak kodnih brojeva gre{aka.
Merenje pH rastvora
Elektrodu izvaditi iz pufera, isprati destilovanom vodom, a zatim
osu{iti upijanjem filtar-hartijom, bez pritiskanja staklene mem-
brane. Elektrodu potopiti u rastvor ~iji se pH odre|uje i pritisnuti
funkcijsku tipku
pH
. Na prikaziva~u se javlja vrednost pH rastvora,
koja se ubrzo stabilizuje.
PA@NJA:
Pri radu sa staklenom ili kombinovanom elektrodom treba biti veo-
ma pa`ljiv, jer je staklena membrana u kru{kastom delu lako lomljiva.
Eksperimentalna fizi~ka hemija
149
Medenica / Male{ev
150
REZULTATI
Tabela 1.
Rezultati merenja na pH metru
pH
PUFERA
pH
ANALIZIRANOG RASTVORA

Za odre|ivanje F
–
jona koristi se membrana od monokristala
LaF
3
, a za odre|ivanje S
2–
jona membrana od presovanog Ag
2
S.
Danas je razvijen veliki broj jon-selektivnih membrana za odre-
|ivanje niza katjona i anjona.
Membrane od te{ko rastvornih soli mogu se primeniti kada u
kristalu soli postoji neka mobilna jonska vrsta koja mo`e da prenosi
naelektrisanje. Provo|enje omogu}ava postojanje defekata u kristal-
noj strukturi i pojavu »upra`njenih mesta«, kroz koja se mogu kre-
tati samo joni odre|enih karakteristika, dok ostali joni ne mogu uti-
cati na provodljivost membrane. Na primer, Ag
+
jon je mobilan u
solima Ag
2
S i AgX, dok je kod LaF
3
mobilan F
–
jon, a LaF
2+
jon je
~vrsto vezan u re{etki.
Kao unutra{nja referentna elektroda naj~e{}e se koristi elektroda
druge vrste, Ag
AgCl, Cl
–
, i u tom slu~aju unutra{nji elektrolit tre-
ba da sadr`i korespondentne jone unutra{nje referentne elektrode i
jonske vrste u membrani. Na primer, unutra{nji elektrolit bromidne
elektrode sadr`i Cl
–
i Br
–
jone, a kod fluoridne elektrode to su Cl
–
i
F
–
joni.
Fluoridna
monokristalna jon-selektivna elektroda prikazuje se
na slede}i na~in:
Ag
AgCl, Cl
–
(a
Cl
–
), F
–
(a
F
–
)
LaF
3
Kako je aktivnost F- jona u unutra{njem elektrolitu poznata i
konstantna, potencijal fluoridne elektrode zavisi samo od aktivnosti
fluoridnih jona u spolja{njem, merenom rastvoru:
Jodidna
jon-selektivna elektroda prikazuje se na slede}i na~in:
Ag
AgCl, Cl
–
(a
Cl
–
), J
–
(a
J
–
)
AgJ
Izraz za potencijal jodidne jon-selektivne elektrode izvodi se na
isti na~in kao i izraz za potencijal kalomelove elektrode (str 128),
tako da kona~ni izraz glasi:
Medenica / Male{ev
152
E = E
K
–
ln
a
F
–
RT
F
(1)
E = E
K
–
ln
a
J
–
RT
F
(2)
Staklena elektroda, koja je opisana u poglavlju »Merenje pH rast-
vora pH-metrom« str 143, pripada grupi jon-selektivnih elektroda
sa ~vrstom membranom.
Jon-selektivne elektrode sa nekristalnom membranom
Membrane ovih elektroda napravljene su obi~no od porozne plas-
ti~ne mase, sinterovanog stakla ili nekog drugog inertnog poroznog
materijala natopljenog rastvara~em ili te~no{}u koja je nerastvorna
u vodi. Za gra|enje te~nih membrana naj~e{}e se koriste jonski iz-
menjiva~i, elektroneutralna makrocikli~na jedinjenja, kvaternerne
amonijum soli i dr.
Detaljniji opisi ovih elektroda mogu se na}i u specijalizovanoj
literaturi o jon-selektivnim elektrodama.
Ekspanzija primene jon-selektivnih elektroda, a u novije vreme i
potenciometrijskih biosenzora, pove}ava mogu}nost kori{}enja po-
tenciometrije u farmaceutskim istra`ivanjima. Danas se ne mo`e za-
misliti instrumentalna laboratorija bez jon-selektivnih elektroda.
Jednostavnost rukovanja, velika osetljivost i preciznost ovih elektro-
da doprinela je njihovoj sve ~e{}oj i {iroj upotrebi. U farmaceutskim
laboratorijama koristi se u kontroli kvaliteta lekova i `ivotnih na-
mirnica, u farmaceutsko-tehnolo{kim istra`ivanjima, toksikolo{koj
hemiji, a u novije vreme i u biohemiji.
Eksperimentalna fizi~ka hemija
153

Eksperimentalna fizi~ka hemija
155
Priprema rastvora
Napraviti 25 mL 1,0 mol L
-1
osnovnog rastvora kalijum-jodida. Od
ovog rastvora (c
1
) napraviti tri rastvora zadatih koncentracija (c
2
).
Koriste}i izraz:
izra~unati zapremine V
1
osnovnog rastvora, koji se odmerava u od-
merne sudove od 50 mL da bi se napravili rastvori zadatih koncen-
tracija. U ove rastvore kalijum-jodida dodati toliku zapreminu kali-
jum-nitrata (1,0 mol L
-1)
da jonska ja~ina (I) u svim rastvorima
bude 0,5. Odmerne sudove dopuniti destilovanom vodom do oz-
nake.
Slika 2.
pH-metar
Radiometer
28 – Copenhagen
1 – glavni prekida~
2 – potenciometar za kalibraciju skale
instrumenta
3 – preklopnik za podru~ja pH/mV
4 – potenciometar za pode{avanje
temperature
5 – skala
6 – jon-selektivna elektroda
7 – kalomelova elektroda
c
1
V
1
= c
2
V
2
(3)
5
4
1
7
6
3
2
Jonsku ja~inu izra~unati iz slede}eg izraza:
gde je:
I – jonska ja~ina
c – koncentracija (katjona K ili anjona A)
z – naelektrisanje (katjona ili anjona).
Merenje na pH-metru
Na pH-metru izabrati odgovaraju}u skalu u mV. Sipati ispitivani
rastvor u ~a{u i u rastvor uroniti referentnu kalomelovu i jodidnu
jon-selektivnu elektrodu.
Elektromotorna sila dobijenog sprega predstavlja razliku poten-
cijala jodidne jon-selektivne i kalomelove elektrode:
gde je:
E
Ag/AgJ, J
–
– potencijal jodidne elektrode:
Medenica / Male{ev
156
....... mL 1,0 mol L
-1
KJ
....... mL 1,0 mol L
-1
KNO
3
(I = 0,5)
dopuniti do 50 mL destilovanom vodom
1.
....... mL 1,0 mol L
-1
KJ
....... mL 1,0 mol L
-1
KNO
3
(I = 0,5)
dopuniti do 50 mL destilovanom vodom
2.
....... mL 1,0 mol L
-1
KJ
....... mL 1,0 mol L
-1
KNO
3
(I = 0,5)
dopuniti do 50 mL destilovanom vodom
3.
Br.
c KCl (mol L
-1
)
Odmeriti
I =
Σ
c
i
. z
2
i
=
(
c
K
. z
2
K
+ c
A
. z
2
A
...)
1
2
1
2
(4)
EMS = E
Ag/AgJ, J–
– E
kal
(5)

Medenica / Male{ev
158
E
kal
= 245 mV
REZULTATI
Tabela 1.
Kalibraciona kriva E = f(log c)
c KJ (mol L
-1
)
log c
1
2
3
< >
EMS (mV)
1
2
3
< >
EMS
x
(mV)
E (mV)
E
x
(mV)
c
x
(mol L
-1
)
E
K
(mV)
RT/F
Grafi~ka
vrednost
RT/F
Teorijska
vrednost
Tabela 2.
Rezultati
Eksperimentalna fizi~ka hemija
159
Potenciometrijska titracija
je kvantitativna elektrohemijska meto-
da za odre|ivanje koncentracije rastvora. Kraj titracije se odre|uje
na osnovu promene potencijala indikatorske elektrode u zavr{noj
ta~ki titracije. Potenciometrijska titracija dobila je ime po tome {to
potencijal elektrode predstavlja indikator zavr{ne ta~ke titracije. Up-
ravo zbog toga je i elektroda, koja ima ulogu indikatora, nazvana in-
dikatorska, jer menja svoj potencijal u zavisnosti od aktiviteta ka-
rakteristi~nih jona u rastvoru. Ova metoda daje ta~nije rezultate od
volumetrijske, a mo`e se koristiti i kod titracija veoma razbla`enih
rastvora, mutnih i obojenih, ili u slu~aju kada ne postoji odgovara-
ju}i indikator. Pored analiti~ke primene, potenciometrijska titracija
se koristi i za odre|ivanje nekih karakteristi~nih veli~ina, kao {to su
konstante protolize kiselina i baza, konstante stabilnosti kompleksa,
proizvod rastvorljivosti i standardni oksidoredukcioni potencijali.
U osnovi potenciometrijske titracije le`e dva procesa uslovljena
jedan drugim. Prvi je hemijski, tj. poznata hemijska reakcija koja na-
staje izme|u analiziranog rastvora i titranta. Drugi je fizi~kohemij-
ski proces, odnosno promena potencijala elektrode kao posledica
hemijske reakcije. Na osnovu ove povezanosti mo`e se pratiti odvi-
janje hemijske reakcije nekog titracionog sistema zahvaljuju}i pro-
meni potencijala indikatorske elektrode.
Potenciometrijska titracija mo`e se izvoditi tako {to se milivolt-
metrom sa velikom otporno{}u meri promena elektromotorne sile
galvanskog sprega, koji se sastoji od analiziranog rastvora (titranda),
referentne i odgovaraju}e indikatorske elektrode. Izbor indikatorske
elektrode zavisi od vrste hemijske reakcije (neutralizacija, talo`enje
ili precipitacija, stvaranje kompleksa i oksidoredukcija) u titracio-
nom sistemu. O izboru odgovaraju}e indikatorske elektrode bi}e re~i
na narednim stranicama ovog ud`benika, kod konkretnih primera.
Kako je potencijal referentne elektrode konstantan, to elektromo-
torna sila zavisi samo od potencijala indikatorske elektrode. Na ovaj
na~in mogu}e je, merenjem promene elektromotorne sile u toku tit-
racije, odrediti zapreminu titranta poznate koncentracije po zavr-
{etku stehiometrijske reakcije izme|u analiziranog rastvora i titranta,
a iz toga izra~unati koncentraciju analiziranog rastvora. U po~etku
titracije elektromotorna sila se neznatno menja, dok je u blizini za-
vr{ne ta~ke titracije ta promena najve}a.
POTENCIOMETRIJSKA TITRACIJA
Teorijski princip

* prira{taj zapremine titranta
** izra~unava se kao koli~nik razlike potencijala dva susedna mere-
nja (
∆
E) i razlike odgovaraju}ih zapremina (
∆
V)
[
npr. (86-84)/(0,2-0), zatim (88-86)/(0,4-0,2) itd.
]
Drugi izvod se izra~unava na isti na~in kao prvi izvod, odnosno
kao »prvi izvod prvog izvoda«.
Prvi, drugi i ostali izvodi ta~no se izra~unavaju interpolacijom
polinoma, {to podrazumeva odre|ene matemati~ke postupke, a koji
su danas sastavni deo mnogih programa za obradu rezultata.
Upotreba potenciometrijskih titracija je veoma {iroka u labora-
torijskim istra`ivanjima pri razli~itim hemijskim reakcijama. Kori-
ste se u svim oblastima farmaceutskih nauka, a neke potenciometrij-
ske titracije su oficinalne u pojedinim farmakopejama.
Eksperimentalna fizi~ka hemija
161
Tabela 1.
Primer izra~unavanja
prvog izvoda krive
Integralna kriva
Prvi izvod
V (mL)
0
0,2
0,4
0,6
0,8
1,0
1,2
1,4
1,6
1,8
2,0
E(mV)
84
86
88
90
98
142
342
360
376
388
398
∆
E/
∆
V**
10
10
10
40
220
1000
90
80
60
50
V(mL)*
0,2
0,4
0,6
0,8
1,0
1,2
1,4
1,6
1,8
2,0
Eksperimentalna fizi~ka hemija
163
Potenciometrijska titracija pri reakciji neutralizacije (pH-metrijska
titracija) zasniva se na pra}enju promene potencijala elektrode oset-
ljive na promenu pH rastvora u toku titracije, odnosno merenju
elektromotorne sile sprega pH indikatorske i referentne elektrode,
uronjene u rastvor koji se titruje. Kao indikatorska elektroda koristi
se bilo koja elektroda osetljiva na promenu pH, a najjednostavnija
za rad je staklena, ~iji je potencijal prikazan izrazom (3) na str 144.
Kao referentna elektroda, naj~e{}e se koristi kalomelova, a njen po-
tencijal dat je izrazom (14) na str 129.
Promena pH titrovanog rastvora ili elektromotorne sile galvan-
skog sprega u toku titracije prati se na milivoltmetru ili pH-metru.
Mogu}e je titrovati i sme{u kiselina ili baza, ali samo pod uslo-
vom da je razlika njihovih konstanti protoliza dovoljno velika. U
tom slu~aju dobija se potenciometrijska titraciona kriva sa jasno de-
finisanim ta~kama infleksije, pa je mogu}e precizno odrediti zavr{-
nu ta~ku titracije svake pojedina~ne kiseline ili baze.
Reakcija neutralizacije
Teorijski princip

ku mernog instrumenta ta~no na vrednost pH pufera (polo`aj ovog
potenciometra ne menjati u toku rada). Posle zavr{ene kalibracije,
pritiskom na prekida~ sa oznakom
std by
(sa~ekati) kazaljku mer-
nog instrumenta vratiti u nulti polo`aj.
Ovim postupkom posti`e se kompenzacija potencijala asimetrije
staklene elektrode.
Postupak
U biretu sipati rastvor titranta (hloridna kiselina). U ~a{u sipati pi-
petom ta~no odmerenu zadatu zapreminu rastvora natrijum-hidro-
ksida i toliku koli~inu vode, da se omogu}i rad magnetne me{alice i
pravilno uranjanje elektroda.
Uklju~iti magnetnu me{alicu i podesiti rad na 800 obrtaja u mi-
nuti. U rastvor pa`ljivo uroniti staklenu i kalomelovu elektrodu.
Preklopnik sa oznakom
range
postaviti na odgovaraju}e podru~je
pH vrednosti. Pritiskom na prekida~ sa oznakom
read
pro~itati
vrednost pH na skali, a zatim kazaljku instrumenta vratiti na nulu
skale pritiskom na prekida~
std by
.
Preklopnikom
range
izabrati odgovaraju}e podru~je za merenje
elektromotorne sile i pro~itati vrednost EMS u mV.
Titrant dodavati u inkrementima od 0,2 mL i o~itavati vrednosti
pH i elektromotorne sile (EMS), kada se igla mernog instrumenta
ustali. Nagla promena pH, odnosno EMS ukazuje na postignutu za-
vr{nu ta~ku titracije. Posle nagle promene izvr{iti jo{ desetak me-
renja.
Iz dobijenih vrednosti EMS izra~unati potencijal staklene elek-
trode E i konstruisati grafike funkcija E = f(V) i
∆
E/
∆
V = f(V). Od-
rediti zavr{nu ta~ku titracije i izra~unati koncentraciju rastvora ti-
tranda.
Grafi~ki prikazati Nernstovu jedna~inu za potencijal staklene
elektrode E = E
K
– 0,0591 pH, odrediti konstantni potencijal E
K
i
dobijeni nagib prave uporediti sa teorijskim.
Rezultate prikazati tabelarno i grafi~ki.
Eksperimentalna fizi~ka hemija
165
Medenica / Male{ev
166
V HCl (mL)
pH
EMS (mV)
E (mV)
Prvi izvod
V (mL)
∆
E /
∆
V
REZULTATI
Tabela 1.
Potenciometrijska titracija natrijum-hidroksida
sa hloridnom kiselinom
E = 244,4 mV (zasi}ena kalomelova elektroda) na t = 20°C

Eksperimentalna fizi~ka hemija
169
Potenciometrijskim titracijama mogu se pratiti i talo`ne reakcije u
kojima je proizvod reakcije te{ko rastvorljivo jedinjenje. Posledica
toga je smanjenje koncentracije karakteristi~nih jona u rastvoru na
koje indikatorska elektroda reaguje, odnosno promena potencijala
indikatorske elektrode.
Srebro-nitrat se naj~e{}e koristi kao titrant za odre|ivanje halo-
genida, merkaptana, sulfida, arsenata, fosfata i oksalata. U tom slu~aju
kao indikatorska elektroda koristi se ili srebrova ili jon-selektivna
srebro-sulfidna elektroda. Referentna kalomelova elektroda mora
biti elektroliti~ki odvojena od indikatorske elektrode zbog prisutnog
Cl
–
jona u elektrolitu same elektrode. Tada se koristi most od agar-
agara uz dodatak kalijum-nitrata ili umesto klasi~ne kalomelove
elektrode koja sadr`i merkuro-hlorid i kalijum-hlorid, elektroda
koja sadr`i merkuro-sulfat i elektrolit kalijum-sulfat, odnosno mer-
kuro-sulfatna elektroda.
Potencijal indikatorske srebrove elektrode dat je slede}im Nern-
stovim izrazom:
Reakcija talo`enja
Teorijski princip
E
Ag+/Ag
= E
0
Ag+/Ag
+
ln
a
Ag+
RT
F
(1)
Aparatura i hemikalije
l
pH-metar MA 5703
Iskra
– Kranj (slika 1)
l
Srebrova elektroda P4011
l
Kalomelova elektroda K401
l
Mehani~ka me{alica
l
Elektroliti~ki most od agar-agara sa dodatkom
amonijum-nitrata
l
Srebro-nitrat
l
Kalijum-hlorid
Priprema
Pripremiti biretu sa rastvorom kalijum-hlorida.
U ~a{u sipati destilovanu vodu i ta~no odmerenu zapreminu
rastvora srebro-nitrata. Uroniti elektrodu od srebra i me{alicu.
Anodni prostor (srebrova elektroda / srebro-nitrat) i katodni
(kalomelova elektroda / kalijum-hlorid) povezati mostom od agar-
agara, napravljenog sa amonijum-nitratom. Tako je pripremljen gal-
vanski spreg, ~ija se elektromotorna sila mo`e meriti.
U analizirani rastvor spustiti me{alicu i pomo}u promenljivog
otpornika podesiti optimalan rad me{alice, tako da se ostvari mirno
me{anje rastvora.
Medenica / Male{ev
170
URADITE SAMOSTALNO ...
Potenciometrijska
titracija
talo`ne reakcije
pomo}u pH-metra
Zadatak eksperimenta
n
Izvr{iti dve titracije zadate zapremine rastvora srebro-nitrata sa
kalijum-hloridom.
n
Vrednosti dobijene drugom titracijom prikazati grafi~ki kao
funkciju EMS = f(V).
n
Odrediti zavr{nu ta~ku titracije grafi~kim putem i izra~unati
broj grama srebra (m) u zadatoj zapremini srebro-nitrata.

Medenica / Male{ev
172
Grafi~ki prikazati funkciju EMS = f(V) i
∆
EMS/
∆
V = f(V) za
drugu titraciju, odrediti zavr{nu ta~ku titracije iz prvog izvoda i iz-
ra~unati broj grama srebra (
m
) u zadatoj zapremini srebro-nitrata.
Primer za izra~unavanje prvog izvoda dat je na strani 161.
Rezultate prikazati tabelarno i grafi~ki.
Eksperimentalna fizi~ka hemija
173
V KCl (mL)
EMS (mV)
V KCl (mL)
EMS (mV)
V KCl (mL)
∆
EMS /
∆
V
I titracija
II titracija
Prvi izvod
REZULTATI
Tabela 1
.
Potenciometrijske titracije EMS = f(V)
Tabela 2.
Rezultati
V AgNO
3
(mL)
c KCl (mol L
-1
)
V KCl
u Z.T.T. (mL)
m Ag (g)

Aparatura i hemikalije
l
Ure|aj za izvo|enje Pogendorfove metode (slika 1, strana 131)
l
Srebrova i kalomelova elektroda
l
Mehani~ka me{alica
l
Elektroliti~ki most od agar-agara
l
Srebro-nitrat
l
Kalijum-hlorid
Priprema
Prema shemi za Pogendorfovu metodu kompenzacije, prikazanoj na
slici 1 (strana 131), obrazovati strujno kolo za odre|ivanje elektro-
motorne sile.
Biretu pripremiti sa standardnim rastvorom kalijum-hlorida. U
~a{u sipati destilovanu vodu i zadatu zapreminu srebro-nitrata od-
merenu pipetom. Uroniti srebrovu i kalomelovu elektrodu i uklju-
~iti me{alicu, tako da se ostvari mirno me{anje rastvora.
Postupak
Kratkim uklju~ivanjem tastera i pomeranjem kliznog kontakta na}i
polo`aj na otporniku kada igla na galvanometru miruje (I = 0). Ovaj
odse~ak, na mostu, izra`en u milimetrima, odrediti prvo za ~ist rastvor
srebro-nitrata. Dodavati kalijum-hlorid u inkrementima od 0,2 mL
i posle svakog dodatka odrediti odse~ak kojim se vr{i kompenzacija.
Posle nagle promene vrednosti odse~ka izvr{iti jo{ toliko merenja da
se dobije pogodna integralna kriva za odre|ivanje zavr{ne ta~ke ti-
Medenica / Male{ev
176
URADITE SAMOSTALNO ...
Potenciometrijska
titracija talo`ne
reakcije po
Pogendorfovoj
metodi kompenzacije
Zadatak eksperimenta
n
Izvr{iti dve titracije zadate zapremine rastvora srebro-nitrata sa
kalijum-hloridom.
n
Vrednosti dobijene drugom titracijom prikazati grafi~ki kao
funkciju a = f(V). Odrediti zavr{nu ta~ku titracije grafi~kim putem
i izra~unati masu srebra (m) u zadatoj zapremini srebro-nitrata.
tracije. Izvesna mala vrednost EMS sprega, odnosno vrednost od-
se~ka, ukazuje da u rastvoru postoji mala koncentracija jona srebra,
uslovljena proizvodom rastvorljivosti srebro-hlorida.
Titraciju ponoviti jo{ jednom sa istom zapreminom rastvora sre-
bro-nitrata uz dodatak manjih inkremenata titranta.
Iz druge titracije konstruisati grafike funkcija:
a = f(V), i
∆
a/
∆
V = f(V)
Odrediti zavr{nu ta~ku titracije iz prvog izvoda i izra~unati masu
srebra u odmerenoj zapremini srebro-nitrata. Primer za izra~una-
vanje prvog izvoda dat je na strani 161.
Rezultate prikazati tabelarno i grafi~ki.
Eksperimentalna fizi~ka hemija
177

Eksperimentalna fizi~ka hemija
179
Tabela 2.
Rezultati
V AgNO
3
(mL)
c KCl (mol L
-1
)
V KCl
u Z.T.T. (mL)
m Ag (g)
Eksperimentalna fizi~ka hemija
181
Potenciometrijskim titracijama se odre|uju koncentracije supstan-
cija u rastvorima u kojima se odigravaju i oksidoredukcioni hemij-
ski procesi sa titrantom. Oksidovani i redukovani oblik nekog jona
~ine oksidoredukcioni sistem ili, kra}e, redoks sistem.
Ox + ne
–
Õ
Red
U toku titracije stvaraju se dva redoks sistema, supstancije koja se
titruje (titrand) i supstancije kojom se titruje (titrant). Prva postoji
do postizanja ta~ke ekvivalencije, a druga posle nje. Potencijal in-
dikatorske elektrode u rastvoru definisan je prisutnim redoks siste-
mom i prikazan op{tim Nernstovim izrazom:
Kao indikatorska elektroda koristi se elektroda od zlata ili plati-
ne, jer hemijski ne reaguje u redoks sistemu i brzo uspostavljaju rav-
note`ni potencijal u zavisnosti od odnosa oksidovanog i redukova-
nog oblika jona.
Do zavr{ne ta~ke titracije potencijal indikatorske elektrode defi-
ni{e redoks sistem rastvora koji se titruje. Posle zavr{ne ta~ke titraci-
je, potencijal indikatorske elektrode definisan je redoks sistemom
koji poti~e od titranta.
Odre|ivanje zavr{ne ta~ke titracije utoliko je ta~nije ukoliko se
potencijali ova dva redoks sistema vi{e razlikuju.
Reakcija oksidoredukcije
Teorijski princip
E = E
0
+
ln
RT
nF
a
ox
a
red
(1)

kati da se rastvor dobro izme{a, odnosno da se izvr{i hemijska reak-
cija:
U toku ove oksidoredukcione titracije stvaraju se dva redoks si-
stema koji defini{u potencijal elektrode:
Fe
2+
Õ
Fe
3+
+ e
–
E
0
= 0,771 V
MnO
4
–
+ 5e
–
+ 8H
+
Õ
Mn
2+
+ 4H
2
O
E
0
=1,510 V
Eksperimentalna fizi~ka hemija
183
Slika 1.
pH-meter
Radiometer
22 – Copenhagen
1 – glavni prekida~
2 – preklopnik »1«
3 – preklopnik »2« (pH/mV)
4 – potenciometar za pode{avanje
temperature
5 – skala
6 – priklju~ak indikatorske elektrode
7 – kalomelova elektroda
10 FeSO
4
+ 2KMnO
4
+ 8H
2
SO
4
Õ
5Fe(SO
4
)
3
+ 2MnSO
4
+ K
2
SO
4
+ 8H
2
O
2
4
1
5
7
3
6
Medenica / Male{ev
184
Pri izboru titranta vodi se ra~una da se standardni potencijali
oba sistema dovoljno razlikuju, da bi se dobila integralna potencio-
metrijska kriva sa jasno definisanom ta~kom infleksije.
Postupak
Proveriti da li se preklopnik »2« nalazi na polo`aju »×1«. Preklopnik
»1« okrenuti udesno na »+ mV«, sa~ekati da se kazaljka umiri i na
skali pro~itati vrednost EMS u mV. Preklopnik »1« vratiti na po~et-
nu poziciju, dodati 0,5 mL rastvora kalijum-permanganata iz birete,
sa~ekati da se rastvor izme{a, tj. da se reakcija stehiometrijski izvr{i i
ponovo pro~itati vrednost EMS na skali. Merenja vr{iti dodavanjem
istih zapremina od 0,5 mL titranta sve dok se ne javi nagli skok EMS.
Kad kazaljka iza|e van opsega skale, preklopnik »2« prebaciti na oz-
naku »+ 500 mV« (na taj na~in se skala ekspandira za 500 mV). Tada
se kazaljka vrati na skalu, a pro~itana vrednost EMS u mV se sabere
sa 500 mV i unese u tabelu. Posle naglog skoka izvr{iti jo{ 4–5 me-
renja, ~ime je titracija zavr{ena.
Do zavr{ne ta~ke titracije potencijal elektrode defini{e odnos
koncentracija Fe
3+
/ Fe
2+
, a posle zavr{ne ta~ke odnos koncentracija
Mn
7+
/ Mn
2+
(MnO
4
–
/ Mn
2+
).
Drugu titraciju uraditi preciznije, dodaju}i manje inkremente ti-
tranta, kako bi se dobila kriva pogodna za ta~no odre|ivanje zavr{ne
ta~ke titracije.
Iz tabele za drugu titraciju izra~unati prvi izvod i grafi~kim
putem prikazati integralnu krivu EMS = f(V) i krivu prvog izvoda
∆
EMS/
∆
V = f(V). Odrediti zavr{nu ta~ku titracije i izra~unati kon-
centraciju rastvora gvo`|e(II)-sulfata.
Primer za izra~unavanje prvog izvoda dat je na strani 161.
Rezultate prikazati tabelarno i grafi~ki.

Medenica / Male{ev
186
Tabela 2.
Rezultati
V FeSO
4
(mL)
c KMnO
4
(mol L
-1
)
V KMnO
4
u Z.T.T. (mL)
c FeSO
4
(mol L
-1
)
(8)
Provodljivost
MERENJE PROVODLJIVOSTI
(KONDUKTOMETRIJA)
Odre|ivanje specifi~ne i molarne
provodljivosti jakih elektrolita
KONDUKTOMETRIJSKA TITRACIJA
Odre|ivanje koncentracije natrijum-hidroksida
Odre|ivanje koncentracije sir}etne kiseline

Specifi~na provodljivost
predstavlja provodljivost rastvora elek-
trolita u posudi oblika kocke stranica 1 m, na ~ijim se suprotnim
stranama nalaze elektrode na rastojanju od 1 m. Jedinice za speci-
fi~nu provodljivost su
Ω
–1
m
–1
, odnosno S . m
–1
.
Iz jedna~ina (3) i (5) sledi:
Odnos
l
/A (gde je
l
– rastojanje izme|u elektroda, a A – povr{ina
elektrode) defini{e tzv.
konstantu konduktometrijske }elije k
(ra-
niji naziv kapacitet posudice):
Ova veli~ina mora ostati nepromenjena u toku merenja, pa se
elektrode moraju nalaziti na stalnom rastojanju. Ovako definisana
konstanta konduktometrijske }elije va`ila bi samo u slu~aju kada bi
elektrode bile zidovi suda. Me|utim, kako to nije slu~aj, linije sila
elektri~nog polja se razilaze (slika 1), pa rastojanje i povr{ina elek-
troda nisu ta~no definisani.
Zato je neophodno
konstantu }elije k
odrediti eksperimentalno
pri prvoj upotrebi, tako {to se meri otpornost rastvora, npr. KCl
poznate koncentracije, ~ija se vrednost specifi~ne provodljivosti na
radnoj temperaturi mo`e na}i tabelarno (tablica 8 u Prilogu). Ovaj
postupak naziva se kalibracija konduktometrijske }elije. Vrednost
konstante k
bi}e nepromenjena sve dok me|usobno rastojanje i fi-
zi~ko stanje elektroda ostanu nepromenjeni. Elektrode su od platine
ili platinirane platine, ~ime se pove}ava efektivna povr{ina elektrode.
Specifi~na provodljivost zavisi od:
o
prirode elektrolita i polarnosti rastvara~a,
o
temperature,
o
koncentracije.
Sa pove}anjem temperature opada viskoznost rastvora, a rastu
brzina kretanja jona i provodljivost. Eksperimentalno je utvr|eno
da sa porastom temperature za 1°C provodljivost raste prose~no za
2%, pa je usled toga neophodno konduktometrijska merenja vr{iti u
termostatu pri konstantnoj temperaturi.
Sa porastom koncentracije, pri konstantnoj temperaturi, pro-
vodljivost u po~etku raste do odre|ene granice, jer se dodatkom
Medenica / Male{ev
190
(6)
1
R
l
A
.
(7)
l
A
k
=
κ
=
Slika 1.
Linije sila elektri~nog polja
izme|u elektroda
elektrolita pove}ava broj jona u rastvoru (slika 2). Pri ve}im koncen-
tracijama elektrolita, provodljivost po~inje da opada. To se obja{nja-
va smanjenjem koncentracije rastvara~a u odnosu na elektrolit, {to
ima za posledica smanjenje stepena disocijacije (protolize), pove-
}anje me|ujonskih sila i stvaranje jonskih asocijata.
Specifi~na provodljivost, odnosno otpor elektrolita meri se me-
todom
Vitstonovog
(Wheatston),
mosta
. Shema ure|aja prikazana
je na slici 3.
Za odre|ivanje provodljivosti elektrolita koristi se niskonapon
ski (desetak volti) izvor naizmeni~ne struje velike frekvencije (~ak i
nekoliko hiljada Hz). U suprotnom, pri prolasku jednosmerne stru-
je kroz elektrolit do{lo bi do elektrohemijske promene elektrolita,
odnosno do promene ne samo koncentracije, ve} i sastava elektroli-
ta. Za dobijanje naizmeni~ne struje koristi se elektronski oscilator
koji je vezan za krajeve otpornika AB.
Kao indikator instrument mo`e se koristiti telefonska slu{alica,
magi~no oko ili osetljiv galvanometar za merenje naizmeni~ne stru-
je. On slu`i kao detektor bestrujnosti u delu kola D – C, tj. kada je
pomeranjem kliznog kontakta D izvr{eno uravnote`enje mosta. Ta-
da je:
R
1
i
R
2
su nepoznati otpori i mogu se izraziti du`inama `ica
a
, od-
nosno
b
.
Eksperimentalna fizi~ka hemija
191
Slika 2.
Zavisnost specifi~ne provodljivosti
od koncentracije
Slika 3.
Shema Vitstonovog mosta
S – izvor naizmeni~ne struje
AB – otpornik
C – trojna ta~ka
D – klizni kontakt
T – indikator instrument
R
x
– nepoznati otpor (elektrolit)
R – otporna dekada
R
x
: R = R
1
: R
2
(8)
R
1
: R
2
= a : b
(9)

Eksperimentalna fizi~ka hemija
193
Molarna provodljivost zavisi od:
o
prirode elektrolita i rastvara~a,
o
razbla`enja,
o
temperature.
Molarna provodljivost nekog binarnog elektrolita predstavlja
funkciju stepena protolize ili disocijacije (
α
) i molarnih jonskih
provodljivosti katjona (
λ
K
+
) i anjona (
λ
A
–
):
Kako se molarna provodljivost menja sa razbla`enjem prikazano
je na slici 4.
Slabi elektroliti nisu u potpunosti disosovani (
α
< 1), a jaki elek-
troliti su potpuno disosovani na jone (
α
= 1). Kod slabih elektrolita
(CH
3
COOH) provodljivost linearno raste, jer sa razbla`enjem raste
i stepen protolize. Ukoliko je stepen protolize ve}i u rastvoru je pri-
sutno vi{e jona, pa je i provodljivost ve}a. Kod jakih elektrolita (HCl)
molarna provodljivost pri malim razbla`enjima je relativno mala, a
sa pove}anjem razbla`enja naglo raste i dosti`e konstantnu vred-
nost, koja se daljim razbla`enjem ne menja. Ova grani~na vrednost
naziva se
molarna provodljivost pri beskona~nom razbla`enju
,
Λ
0
ili
Λ
∞
. To je konstantna veli~ina za svaki elektrolit na datoj tempera-
turi i predstavlja provodljivost rastvora kada koncentracija te`i nuli,
odnosno kada je razbla`enje
ϕ
jako veliko.
Prema jedna~ini (16), molarna provodljivost pri beskona~nom
razbla`enju jednaka je zbiru molarnih jonskih provodljivosti pri
beskona~nom razbla`enju:
Molarne jonske provodljivosti
pri beskona~nom razbla`enju su
karakteristi~ne vrednosti na datoj temperaturi (tablica 9 u Prilogu).
Λ
=
α
(
λ
K
+
+
λ
A
–
)
(16)
Λ
0
=
λ
0
K
+
+
λ
0
A
–
(18)
Λ
0
= lim
Λ
(17)
Slika 4.
Zavisnost molarne provodljivosti
od razbla`enja
c
Õ
0
Medenica / Male{ev
194
Molarna provodljivost pri beskona~nom razbla`enju jakih elek-
trolita mo`e se odrediti grafi~kim putem iz
Kolrau{ovog
(Kohl-
rausch) empirijskog
zakona kvadratnog korena
:
gde su
a
i
b
empirijske konstante za svaki elektrolit.
Ako c
Õ
0, onda i
b
√
c
Õ
0, pa sledi da je a =
Λ
0
,
odnosno:
Ovo zna~i da Kolrau{ov zakon kvadratnog korena predstavlja
jedna~inu prave koja se grafi~ki prikazuje kao na slici 5.
Konstanta
b
mo`e se odrediti kao tangens ugla prave:
odnosno:
Za slabe elektrolite
Λ
0
ne mo`e se grafi~kim putem odrediti .
Iz molarne provodljivosti mogu se odrediti prenosni brojevi
katjona i anjona, kao i va`ni fizi~kohemijski parametri – stepen pro-
tolize, konstanta protolize i proizvod rastvorljivosti te{ko rastvorne
soli.
Prema jedna~inama (16) i (18)
stepen protolize
dat je izrazom:
Iz molarne provodljivosti i stepena protolize mo`e se izra~unati i
konstanta protolize. Slabi elektroliti u rastvorima ne disosuju pot-
puno (
α
<1), ve} postoji ravnote`a izme|u molekula i jona.
Λ
c
=
a – b
√
c
(19)
Λ
c
=
Λ
0
– b
√
c
(20)
Slika 5.
Grafi~ki prikaz Kolrau{ovog zakona
kvadratnog korena
b =
Λ
c
1
–
Λ
c
2
√
c
2
–
√
c
1
(21)
b =
= tg
α
∆Λ
∆√
c
(22)
α
=
Λ
Λ
0
(23)
KA
K
+
+ A
–
(24)
Λ
2
Λ
1
Λ
0
Λ

Aparatura i hemikalije
l
Konduktometar MA 5962
Iskra
– Kranj (slika 6)
l
Konduktometrijska }elija
l
Termostat
l
Rastvor kalijum-hlorida
Na prikazanom konduktometru skala je ba`darena u jedinicama ot-
pora, a indikator instrument je osetljiv instrument sa kazaljkom.
Pored toga, indikator instrument mo`e biti i magi~no oko.
Kalibracija konduktometrijske }elije
Ovaj postupak podrazumeva odre|ivanje konstante
k
, koja pred-
stavlja odnos rastojanja
l
izme|u elektroda i povr{ine elektrode
A
.
Odre|ivanje se vr{i merenjem otpornosti rastvora KCl poznate kon-
centracije, za koji se vrednost specifi~ne provodljivosti
κ
, na radnoj
temperaturi, nalazi u tablici 8 u Prilogu.
Priprema
U posudu za konduktometriju sipati malo rastvora elektrolita ~ija se
provodljivost odre|uje i isprati elektrode. Isprazniti posudu, a zatim
sipati rastvor i staviti posudu u termostat.
Elektrode celom povr{inom spustiti u rastvor, kako se konstanta
elektrode ne bi promenila (slika 7). Doterati temperaturu termosta-
ta ta~no na 20°C i rastvor termostatirati najmanje 10 minuta pre
merenja.
Medenica / Male{ev
196
U
UR
RA
AD
DIIT
TE
E S
SA
AM
MO
OS
ST
TA
AL
LN
NO
O ......
Odre|ivanje
specifi~ne i molarne
provodljivosti
jakih elektrolita ( I )
Zadatak eksperimenta
n
Izmeriti otpore dobijenih rastvora elektrolita i izra~unati speci-
fi~nu i molarnu provodljivost. Grafi~kom metodom i ra~unskim
putem odrediti parametre Kolrau{ove jedna~ine.
Postupak
a)
Prebaciti mre`ni prekida~
power
u polo`aj
on
(uklju~eno). Pali
se signalna lampica i aparat je spreman za merenje.
b)
Potra`iti preklopnikom za podru~ja,
range
(podru~je), najmanji
otklon kazaljke u smeru strelice na indikator instrumentu. Zatim sa
faktorima multiplikacije podru~ja,
range multiplier
(multiplika-
cija podru~ja), podesiti najmanji mogu}i otklon. Otpor merenog
rastvora elektrolita predstavlja proizvod vrednosti koju pokazuju
preklopnici
range
i
range multiplier
. Za svaki rastvor merenje
otpora ponoviti po tri puta. Izra~unati srednju vrednost.
Eksperimentalna fizi~ka hemija
197
Slika 6.
Konduktometar
MA 5962
Iskra
– Kranj
1 – glavni prekida~
2 – priklju~ak konduktometrijske }elije
3 – preklopnik podru~ja
4 – faktori multiplikacije
5 – indikator instrument
6 – konduktometrijska }elija
7 – termometar
8 – analizirani rastvor
9 – termostat
Slika 7.
Konduktometrijska }elija
7
8
9
6
1
4
3
2
5

t = .......°C
k = 0,001834 m
–1
Ω
–1
= S (simens)
Eksperimentalna fizi~ka hemija
199
REZULTATI
Tabela 1.
Rezultati merenja
Rastvor
R
1
(
Ω
)
R
2
(
Ω
)
R
3
(
Ω
)
< R > (
Ω
)
κ
(
Ω
–1
m
–1
) c (mol L
-1
) c (mol m
-3
)
Λ
(
Ω
–1
m
2
mol
–1
)
1
2
3
Λ
=
Λ
0
– b
√
c
Λ
0
(
Ω
–1
m
2
mol
–1
)
b
Tabela 2.
Parametri Kolrau{ove jedna~ine
Aparatura i hemikalije
l
Konduktometar HI8820N
Hanna instruments
(slika 8)
l
Konduktometrijska }elija
l
Termostat
l
Rastvor za kalibraciju
Odre|ivanje temperaturnog koeficijenta provodljivosti
U konduktometrijsku }eliju sipati malo rastvora elektrolita ~ija se
provodljivost odre|uje i isprati je. Isprazniti posudu, sipati rastvor i
staviti posudu u vodeni termostat.
Konduktometrijsku }eliju uroniti u rastvor najvi{e do 1 cm ispod
oznake.
Prebaciti mre`ni prekida~ u polo`aj
on
.
Podesiti potenciometar za temperaturni koeficijent na 0% (ne-
ma kompenzacije).
Doterati temperaturu rastvora na 25°C i izmeriti provodljivost
rastvora,
κ
25
. (Izabrati odgovaraju}i opseg merenja u
µ
S. Ukoliko se
na prikaziva~u pojavi »1«, provodljivost uzorka nalazi se izvan oda-
branog mernog podru~ja.)
Doterati temperaturu rastvora na npr. t = 35°C i izmeriti pro-
vodljivost rastvora
κ
t
.
Temperaturni koeficijent
β
izra~unava se po slede}oj formuli:
Medenica / Male{ev
200
URADITE SAMOSTALNO ...
Odre|ivanje
specifi~ne i molarne
provodljivosti
jakih elektrolita ( II )
Zadatak eksperimenta
n
Odrediti temperaturski koeficijent provodljivosti rastvora.
n
Izmeriti specifi~ne provodljivosti dobijenih rastvora elektrolita
i izra~unati molarne provodljivosti.
n
Grafi~kom metodom i ra~unskim putem odrediti parametre
Kolrau{ove jedna~ine.
β
=
100
(
κ
t
–
κ
25
)
(t –
25
) .
κ
25
(36)

Merenje provodljivosti
a) Postaviti potenciometar za pode{avanje temperaturnog koefici-
jenta na prethodno odre|enu vrednost.
b) Izmeriti vrednosti specifi~ne provodljivosti za dobijene rastvore.
(Vrednost provodljivosti bi}e automatski kompenzovana za vari-
jacije temperature.) Za svaki rastvor ponoviti merenja tri puta.
Izra~unavanje
a) Za date koncentracije elektrolita izra~unati molarne provodlji-
vosti
Λ
:
b) Nacrtati Kolrau{ov grafik i odrediti parametre jedna~ine:
Sa grafika odrediti molarnu provodljivost pri beskona~nom raz-
bla`enju
Λ
0
(odse~ak na ordinati) i konstantu
b
(nagib prave):
Rezultate prikazati tabelarno i grafi~ki.
Medenica / Male{ev
202
Λ
=
κ
c
(37)
b = tg
α
=
∆Λ
∆√
c
(39)
Λ
=
Λ
0
– b
√
c
(38)
t = .......°C
β
= ..........°C
–1
Eksperimentalna fizi~ka hemija
203
REZULTATI
Tabela 1.
Rezultati merenja
Rastvor
κ
1
(S m
–1
)
κ
2
( S m
–1
)
κ
3
(S m
–1
) <
κ
> (S m
–1
) c (mol L
-1
) c (mol m
-3
)
Λ
(S m
2
mol
–1
)
1
2
3
Λ
=
Λ
0
–
√
c
Λ
0
(S m
2
mol
–1
)
b
Tabela 2.
Parametri Kolrau{ove jedna~ine

Titracija slabe kiseline jakom bazom
(slika 3)
CH
3
COOH + Na
+
+ OH
–
H
2
O + Na
+
+ CH
3
COO
–
U toku titracije, npr. CH
3
COOH sa NaOH, na samom po~etku
provodljivost je mala zbog slabe disocijacije sir}etne kiseline. Do
Z.T.T. provodljivost postepeno raste jer je proizvod hemijske re-
akcije CH
3
COONa, ja~i elektrolit od onog po~etnog. Posle Z.T.T.
provodljivost naglo raste usled dodatka jake baze, kada su nosioci
provodljivosti hidroksilni joni. Nagib krive zavisi od koncentracije
titranta i ugao koji zaklapaju grane konduktometrijske krive utoliko
je manji, ukoliko je ve}a koncentracija titranta. Na taj na~in mo`e se
preciznije odrediti Z.T.T. Zakrivljenost krive u blizini Z.T.T poti~e
od hidrolize nastalog natrijum-acetata.
Titracija slabe kiseline slabom bazom
(slika 4)
CH
3
COOH + NH
4
OH
H
2
O + NH
4
+
+ CH
3
COO
–
Titracijom npr. CH
3
COOH sa NH
4
OH, u po~etku titracije, i sve
do Z.T.T, provodljivost raste usled nastajanja soli amonijum-acetata
koja u izvesnoj meri disosuje. Posle Z.T.T. provodljivost se prakti~no
ne menja jer je disocijacija amonijum-hidroksida suzbijena nastalim
amonijum-acetatom. Zakrivljenost krive u blizini Z.T.T. posledica je
hidrolize nastale soli, pa se Z.T.T. odre|uje ekstrapolacijom grana
konduktometrijske krive.
Titracija sme{e jake i slabe kiseline jakom bazom
(slika 5)
Titracijom sme{e, npr. HCl i CH
3
COOH sa NaOH, nastaje prvo
neutralizacija jake (ta~ka A), a zatim slabe kiseline (ta~ka B). Do ta~-
ke A provodljivost opada zbog smanjenja koncentracije brzih hidro-
gen jona jake kiseline. Posle Z.T.T (A) po~inje disocijacija slabe kise-
line i titracijom nastaje elektrolit natrijum-acetat, koji je ja~i od
same sir}etne kiseline, pa provodljivost blago raste. Posle Z.T.T. i
druge kiseline (B), provodljivost naglo raste i poti~e od prisutnih hi-
droksilnih jona titranta u vi{ku, koji imaju veliku jonsku provod-
ljivost.
Medenica / Male{ev
206
Slika 3.
Titracija slabe kiseline jakom bazom
Slika 4.
Titracija slabe kiseline slabom bazom
Slika 5.
Titracija sme{e jake i slabe kiseline
jakom bazom
H
+
+ Cl
–
+ CH
3
COOH + Na
+
+ OH
–
H
2
O + Na
+
+ Cl
–
+ CH
3
COO
–
Mogu}e je titrovati i dve slabe kiseline u sme{i, ali jedino pod
uslovom da im se pKa vrednosti razlikuju najmanje za jednu jedinicu.
Pored reakcija neutralizacije, konduktometrijskom titracijom
mogu se pratiti i
reakcije talo`enja
(
precipitacije
) (slika 6). Pri titraci-
ji, npr. AgNO
3
sa KCl, deo krive (1) pokazuje neznatnu promenu u
provodljivosti koja nastaje usled zamene srebro jona sa kalijum joni-
ma, a koji imaju malo ve}u jonsku provodljivost.
Ag
+
+ NO
3
–
+ K
+
+ Cl
–
AgCl + K
+
+ NO
3
–
Posle Z.T.T. provodljivost se znatnije menja zbog prisustva hlorid-
nih jona titranta koji imaju jo{ ve}u jonsku provodljivost. ^e{}e se,
umesto kalijum-hlorida, koristi litijum-hlorid kao titrant, zbog ve}e
razlike u jonskim provodljivostima Li
+
i Ag
+
jona.
Kompleksometrijske titracije
mogu se konduktometrijski pratiti
jedino u slu~aju stabilnih kompleksa.
Ovom metodom ne mogu se pratiti oksido-redukcione reakcije,
jer se promenom valentnog stanja jona neznatno menja i njegova
provodljivost.
Konduktometrijska titracija koristi se u onim slu~ajevima kada
se ne mo`e upotrebiti indikator (mutni i obojeni rastvori) ili da bi se
izbegla upotreba indikatora i time otklonila subjektivna gre{ka. Ta-
ko|e se koristi kod titracija veoma razbla`enih rastvora. Jednostav-
nost i osetljivost ove metode omogu}ava njenu primenu u kvantita-
tivnoj analizi mnogobrojnih aktivnih principa u farmaceutskim
preparatima.
U slu~aju da se na mernom instrumentu ure|aja prate promene
otpora rastvora, titraciona kriva ima obrnuti tok od onog kada se
prati provodljivost. Tako }e titraciona kriva u slu~aju titracije jake
kiseline jakom bazom imati izgled kao na slici 7, jer su otpor i pro-
vodljivost obrnuto proporcionalne veli~ine.
Prilikom titracije mora se voditi ra~una o koncentraciji titranta.
Naime, koncentracija titranta mora biti najmanje deset puta ve}a od
koncentracije analiziranog rastvora. Ako to nije slu~aj, javlja se tzv.
efekat razbla`enja
, koji mora dovesti do gre{ke u odre|ivanju Z.T.T.
To se mo`e izbe}i mno`enjem izmerene vrednosti otpora ili provod-
ljivosti sa
faktorom korekcije (f )
:
Eksperimentalna fizi~ka hemija
207
Slika 6.
Titracija srebro-nitrata
sa kalijum-hloridom
Slika 7.
Titracija jake kiseline jakom bazom

Eksperimentalna fizi~ka hemija
209
U
UR
RA
AD
DIIT
TE
E S
SA
AM
MO
OS
ST
TA
AL
LN
NO
O ......
Odre|ivanje
koncentracije
natrijum-hidroksida
Zadatak eksperimenta
n
Izvr{iti dve titracije zadate zapremine natrijum-hidroksida sa
hloridnom kiselinom.
n
Vrednosti ta~aka za obe titracije ucrtati u isti koordinatni
sistem kao R = f(V). Iz srednje vrednosti zavr{nih ta~aka titracije,
odre|enih grafi~kim putem, odrediti broj grama (m)
natrijum-hidroksida u rastvoru.
Slika 8.
Konduktometar
MA 5961
Iskra
– Kranj
1 – konduktometrijska }elija
2 – analizirani rastvor
3 – magnetna me{alica
4 – preklopnik mernog podru~ja
5 – kru`na skala
6 – indikator instrument – magi~no
oko
5
6
1
4
2
3
Medenica / Male{ev
210
Aparatura i hemikalije
l
Konduktometar MA 5961
Iskra
– Kranj (slika 8)
l
Konduktometrijska }elija PP1042
l
Magnetna me{alica
l
Natrijum-hidroksid
l
Hloridna kiselina
Priprema
U ~a{u za titraciju, u kojoj se nalazi magnet, odmeriti odre|enu za-
preminu natrijum-hidroksida i toliku koli~inu destilovane vode da
otvori na konduktometrijskoj }eliji budu ispod nivoa rastvora. Vodi-
ti ra~una da staklena konduktometrijska }elija ne dodiruje magnet.
Uklju~iti magnetnu me{alicu tako da se obezbedi mirno me{anje
rastvora, paze}i da magnet ne o{teti }eliju. U toku titracije odr`avati
brzinu me{alice konstantnom.
Titracija
Uklju~iti aparat u struju i potenciometar sa oznakom
ob~utljivost
(osetljivost) okrenuti udesno do maksimalnog polo`aja. Preklopnik
za biranje mernog podru~ja otpora okretati sve dok se ne na|e po-
dru~je pri kome se magi~no oko otvori. Pre po~etka titracije odredi-
ti ta~nu vrednost otpora rastvora pomo}u kru`ne skale.
Vrednost otpora ~itati pri maksimalnoj {irini tamnog sektora na
magi~nom oku. Ovu vrednost zapisati u tabelu, dodati odre|enu za-
preminu hloridne kiseline iz birete i pro~itati vrednost otpora na ve}
opisani na~in. Ovaj postupak ponavljati sve dok se, posle maksi-
malne vrednosti otpora, ne izmere jo{ najmanje ~etiri vrednosti.
Izvr{iti dve titracije zadate zapremine natrijum-hidroksida. U prvoj
titraciji dodavati hloridnu kiselinu u inkrementima od 0,3 mL, a u
drugoj od 0,2 mL.
Pri o~itavanju voditi ra~una o vrednostima odse~aka na skali pri
prelasku sa jednog na drugo merno podru~je otpora.
Rezultate merenja prikazati tabelarno i grafi~ki.

Aparatura i hemikalije
l
Konduktometar MA 5962
Iskra
– Kranj (slika 9)
l
Konduktometrijska }elija
l
Magnetna me{alica
l
Sir}etna kiselina
l
Natrijum-hidroksid
Priprema
U ~a{u za titraciju, u kojoj se nalazi magnet, odmeriti odre|enu za-
preminu sir}etne kiseline i toliku koli~inu destilovane vode da kon-
duktometrijska }elija bude pravilno postavljena. Voditi ra~una da
stakleni deo konduktometrijske }elije ne dodiruje magnet. Uklju~iti
magnetnu me{alicu tako da se obezbedi mirno me{anje rastvora,
paze}i da magnet ne o{teti }eliju. U toku titracije odr`avati brzinu
me{alice konstantnom.
Titracije
a) Prebaciti mre`ni prekida~
power
u polo`aj
on
. Pali se signalna
lampica i aparat je spreman za merenja.
b) Potra`iti preklopnikom za podru~ja
range
(podru~je) najmanji
otklon kazaljke u smeru strelice na indikator instrumentu. Zatim sa
faktorima multiplikacije,
range multiplier
(multiplikacija pod-
ru~ja), podesiti najmanji mogu}i otklon. Otpor rastvora elektrolita
predstavlja proizvod vrednosti koju pokazuje preklopnik
range
i
range multiplier
.
Medenica / Male{ev
212
U
UR
RA
AD
DIIT
TE
E S
SA
AM
MO
OS
ST
TA
AL
LN
NO
O ......
Odre|ivanje
koncentracije
sir}etne kiseline
Zadatak eksperimenta
n
Izvr{iti dve titracije zadate zapremine sir}etne kiseline sa
natrijum-hidroksidom.
n
Vrednosti ta~aka za obe titracije ucrtati u isti koordinatni
sistem kao R = f(V). Iz srednje vrednosti zavr{nih ta~aka titracije,
odre|enih grafi~kim putem, odrediti koncentraciju sir}etne
kiseline.
c) Posle svakog dodatka titranta odrediti vrednost otpora rastvora.
Izvr{iti dve titracije zadate zapremine sir}etne kiseline.
Rezultate merenja prikazati tabelarno i grafi~ki.
Eksperimentalna fizi~ka hemija
213
Slika 9.
Konduktometar
MA 5962
Iskra
– Kranj
1 – konduktometrijska }elija
2 – analizirani rastvor
3 – magnetna me{alica
4 – mre`ni prekida~
5 – preklopnik podru~ja
6 – faktori multiplikacije
7 – indikator instrument
8 – priklju~ak konduktometrijske }elije
7
1
2
8
5
6
4
3

(9)
Brzina hemijskih
reakcija
RED REAKCIJA
Odre|ivanje konstante brzine
hidrolize saharoze
Eksperimentalna fizi~ka hemija
217
U hemiji su definisane dve vrste reakcija, kona~ne i povratne ili rav-
note`ne. Kod kona~nih reakcija je, primenom najosetljivijih anali-
ti~kih metoda, mogu}e samo konstatovati prisustvo reaktanata. Na-
protiv, kod ravnote`nih reakcija mogu se odrediti koncentracije i
reaktanata i proizvoda reakcije, koje imaju konstantne vrednosti na
odre|enoj temperaturi.
Hemijska kinetika se bavi ispitivanjem brzine kona~nih i rav-
note`nih reakcija, a ovde }e biti razmatrane brzine kojim se odigra-
vaju kona~ne reakcije. Neke reakcije se odigravaju trenutno, u roku
od milionitog dela sekunde, a neke mogu trajati hiljadama godina.
Iz vremena trajanja reakcije odre|uje se brzina reakcije, odnosno
koli~ina supstancije koja izreaguje ili nastane u jedinici vremena, a
sti~u se i saznanja o mehanizmu reakcije. U farmaciji se hemijska
kinetika primenjuje u biofarmaceutskim i farmakokineti~kim ispiti-
vanjima lekova, kao i za prou~avanje stabilnosti farmaceutskih
preparata, koja zavisi od brzine razlaganja aktivnih supstancija.
Brzina hemijske reakcije defini{e se kao promena koncentracije
supstancije, koja reaguje ili nastaje, u jedinici vremena:
Koncentracija reaktanata se smanjuje u toku reakcije, a koncentraci-
ja proizvoda raste, pa brzina promene koncentracije reaktanata ima
negativan, a brzina nastajanja proizvoda reakcije pozitivan predznak.
Prema tome, brzina reakcije tipa:
A + B
Õ
C + D
mo`e se predstaviti na jedan od ~etiri mogu}a na~ina:
Brzina hemijske reakcije zavisi od koncentracije supstancije, pri-
rode supstancije i temperature na kojoj se reakcija odigrava.
RED REAKCIJA
Teorijski princip
v =
dc
dt
(1)
v = –
= –
dc
A
dt
=
dc
B
dt
=
dc
C
dt
dc
D
dt
(2)

Da bi se ova reakcija odigrala, potrebno je da se sudare dva mole-
kula koji imaju odgovaraju}e energije aktivacije, a to je energija koju
molekul mora imati da bi mogao hemijski da reaguje. Prema jedna-
~ini (2), brzina bimolekulske reakcije mogla bi se prikazati na sle-
de}i na~in:
gde je
k
II
konstanta brzine bimolekulske reakcije.
Izraz za konstantu brzine
k
II
mo`e se izvesti ako su po~etne kon-
centracije reaktanata A i B jednake. Posle vremena
t
bi}e i c
A
= c
B
, pa
se jedna~ina (7) mo`e napisati na slede}i na~in:
Preure|enjem i integraljenjem jedna~ine (8) dobija se:
a re{enjem jedna~ine (9):
Odatle je:
U
trimolekulskim reakcijama
mora do}i do istovremenog sudara
tri molekula. Verovatno}a odigravanja trimolekulskih reakcija je
veoma mala, pa se takve reakcije naj~e{}e de{avaju u vi{e stupnjeva u
kojima u~estvuju najvi{e dva molekula.
Polimolekulske reakcije
odigravaju se u vi{e stupnjeva, jer vero-
vatno}a da }e se istovremeno sudariti ~etiri, pet ili vi{e molekula je
prakti~no jednaka nuli. Brzinu polimolekulskih reakcija odre|uje
najsporija reakcija, koja mo`e biti mono-, bi- ili trimolekulska.
Eksperimentalna fizi~ka hemija
219
v = –
= k
II
. c
A
. c
B
dc
A
dt
(7)
–
= k
II
. c
2
A
dc
A
dt
(8)
(9)
∫
c
A
c
0
–
∫
t
t = 0
k
II
=
dt
dc
A
c
2
A
(10)
–
–
–
= k
II
. t
1
c
A
–
1
c
0
(11)
k
II
=
–
1
c
A
1
t
1
c
0
Medenica / Male{ev
220
Koncentracija reaktanta A stepenovana je jedinicom u jedna~ini
za brzinu monomolekulskih reakcija (3), dvojkom u jedna~ini za br-
zinu bimolekulskih reakcija (8) i trojkom u jedna~ini za brzinu tri-
molekulskih reakcija, pa op{ti izraz za brzinu hemijske reakcije ima
slede}i oblik:
Eksponent
n
naziva se
red reakcije
, a
v
– brzina reakcije n-tog reda.
Monomolekularnost i red reakcije se poklapaju, pod uslovom da
je reakcija jednostavna, odnosno da se odigrava bez sekundarnih
efekata, kao {to su nastajanje intermedijarnih proizvoda, reverzibil-
nih ili bo~nih reakcija. Me|utim, kod slo`enih reakcija, mono-, bi-,
tri- i polimolekulskih, koje se de{avaju u vi{e stupnjeva, brzina reak-
cije je odre|ena najsporijim procesom, pa se molekularnost i red
reakcije mogu razlikovati. Na primer, petomolekulska reakcija dobi-
janja joda iz vodonik-peroksida i jodidne kiseline, odigrava se u dva
stupnja. Prvi, sporiji proces predstavlja reakciju drugog reda (n = 2),
{to zna~i da ova petomolekulska reakcija ima brzinu drugog reda.
Prema tome, molekularnost se defini{e kao broj molekula reaktana-
ta koji u~estvuju u reakciji, a red reakcije kao zbir eksponenata (n
1
+
n
2
+ ..... + n
i
= n) u jedna~ini za brzinu hemijske reakcije (12).
Postoji vi{e metoda za odre|ivanje reda reakcije. Ako se za
n
ne
dobije ceo broj, zna~i da takva reakcija sadr`i bar dve intermedijar-
ne, najsporije reakcije sli~nih konstanti brzina.
Postoji poseban tip bimolekulskih reakcija, za koje va`i jedna~ina
za brzinu reakcije prvog reda. Po{to se jedan od reaktanata nalazi u
velikom vi{ku, njegova koncentracija ostaje prakti~no nepromenje-
na po zavr{etku reakcije, pa se mo`e smatrati konstantnom. Brzine
ovakvih bimolekulskih reakcija ne razlikuju se od brzine reakcija pr-
vog reda, zbog ~ega se takve reakcije nazivaju
reakcije pseudo-prvog
reda
. Primer ovakve reakcije je hidroliza disaharida (npr. saharoze)
u prisustvu hidrogen jona kao katalizatora, pri ~emu nastaju mono-
saharidi glukoza i fruktoza:
v = –
= k
n
. c
n
A
dc
A
dt
(12)
C
12
H
22
O
11
+ H
2
O
C
6
H
12
O
6
+ C
6
H
12
O
6
saharoza
glukoza fruktoza

Medenica / Male{ev
222
Zamenom ovih vrednosti u jedna~inu (6) sledi:
odnosno:
Konstanta brzine reakcije pseudo-prvog reda (
k
) mo`e se odrediti
kao nagib prave, odnosno koeficijent pravca prikazane linearne loga-
ritamske funkcije.
k =
log
2,303
t
α
0
–
α
∞
α
t
–
α
∞
(15)
2,303 log
(
α
t
–
α
∞
)
= 2,303 log
(
α
0
–
α
∞
) – k . t
(16)
Eksperimentalna fizi~ka hemija
223
U
UR
RA
AD
DIIT
TE
E S
SA
AM
MO
OS
ST
TA
AL
LN
NO
O ......
Odre|ivanje
konstante brzine
hidrolize saharoze
Zadatak eksperimenta
n
Pripremiti rastvor saharoze sa hloridnom kiselinom i meriti
promenu ugla skretanja ravni polarizovane svetlosti.
n
Izra~unati konstantu brzine hidrolize saharoze.
n
Grafi~ki prikazati funkciju: log (
α
t
–
α
∞
) = f(t) i odrediti
konstantu brzine hidrolize saharoze kao nagib prave.
Aparatura i hemikalije
l
Polarimetar (slika 11, strana 69)
l
Hronometar
l
Saharoza
l
Hloridna kiselina
Postupak
Pripremiti 100 mL 20%-tnog rastvora saharoze. Rastvor profiltrirati
da bude potpuno bistar. Izmeriti ugao skretanja ovog rastvora (
α
).
Ugao
α
0
iznosi polovinu ugla
α
, jer se za dalji postupak rastvor sa-
haroze razbla`uje u odnosu 1:1 sa hloridnom kiselinom.
Odmeriti 25 mL rastvora saharoze, dodati 25 mL 6 mol L
–1
rast-
vora hloridne kiseline i odmah uklju~iti hronometar, po{to reakcija
po~inje da te~e. Napuniti polarimetarsku cev ovim rastvorom i me-
riti promenu ugla skretanja ravni polarizovane svetlosti. Ostatak rast-
vora zagrevati oko pola sata na 50°C da bi, ubrzanjem reakcije, do{lo
do potpune hidrolize. Zatim rastvor ohladiti i izmeriti ugao
α
∞
.
Grafi~ki prikazati funkciju: log (
α
t
–
α
∞
) i odrediti konstantu br-
zine hidrolize saharoze kao nagib prave.
Izra~unati vrednost konstante brzine hemijske reakcije hidrolize
saharoze pod kataliti~kim dejstvom hloridne kiseline. Ako se izra~u-
nate vrednosti za konstantu brzine reakcije sla`u, obra~unate za ra-
zli~ite vremenske intervale, to je dokaz da se radi o brzini monomo-
lekulske reakcije.
Rezultate prikazati tabelarno i grafi~ki.

(10)
Procesi
na granici faza
ADSORPCIJA
Gibzova adsorpciona izoterma
Frojndlihova adsorpciona izoterma
227
Eksperimentalna fizi~ka hemija
Na grani~nim povr{inama ~vrste i te~ne faze postoje nekompenzo-
vane molekulske, atomske ili jonske sile privla~enja.
U unutra{njosti te~ne faze molekul je sa svih strana okru`en dru-
gim molekulima, pa je rezultanta privla~nih sila, koje deluju na taj
molekul, jednaka nuli. Me|utim, kod molekula na povr{ini te~nosti
rezultanta privla~nih sila usmerena je ka unutra{njosti te~nosti, jer
je broj molekula u jedinici zapremine u te~noj fazi ve}i nego u gas-
noj. Posledica postojanja asimetri~nih sila privla~enja je te`nja te~-
nosti da zauzme {to manju povr{inu, koja se zbog toga naziva
povr{inski napon
. To je razlog {to kapi te~nosti imaju sferni oblik,
jer u tom slu~aju telo date zapremine zauzima najmanju povr{inu.
Rastvorena supstancija mo`e smanjiti ili pove}ati povr{inski na-
pon rastvara~a, {to zavisi od interakcije izme|u molekula rastvara~a
i molekula ili jona rastvorka. Kad su privla~ne sile izme|u molekula
rastvorka manje od privla~nih sila izme|u molekula rastvara~a, {to
zna~i da rastvorak ima manji povr{inski napon od rastvara~a, mole-
kuli rastvorka }e se ugra|ivati u grani~ni sloj i smanjivati povr{inski
napon rastvara~a. Po{to je unutra{nji pritisak rastvara~a ve}i od po-
vr{inskog, koncentracija rastvorka bi}e ve}a u grani~nom sloju nego
u unutra{njosti rastvara~a, jer svaki sistem te`i ravnote`nom stanju,
u kome posti`e minimum energije. U suprotnom, kad su me|umo-
lekulske privla~ne sile rastvorka ve}e, povr{inski napon rastvara~a je
manji, a koncentracija rastvorka ve}a u unutra{njosti rastvara~a.
Pojava razli~ite koncentracije rastvorka u grani~nom sloju i u
unutra{njosti rastvora naziva se
adsorpcija
. Prema tome da li je
koncentracija rastvorka u povr{inskom sloju pove}ana ili smanjena,
razlikuju se pozitivna i negativna adsorpcija. Supstancije koje sma-
njuju povr{inski napon rastvara~a i nagomilavaju se na povr{ini
zovu se
povr{inski
ili
kapilarno aktivne
, a one koje pove}avaju po-
vr{inski napon rastvara~a i ~ija je koncentracija u povr{inskom sloju
manja, nazivaju se
povr{inski inaktivne
. Supstancija koja ima oso-
binu da adsorbuje na svojoj povr{ini zove se
adsorbens
, a adsorbo-
vana supstancija
adsorbat
.
Adsorpcija zavisi od fizi~kih i hemijskih osobina adsorbensa i
adsorbata, spolja{njeg pritiska i temperature. Pri ovim uslovima,
koli~ina adsorbovane supstancije proporcionalna je povr{ini adsor-
bensa i koncentraciji adsorbata.
ADSORPCIJA
(latinski
adsorptio
– zgu{njavanje)
Teorijski princip

Ispitivanja pokazuju da koli~ina adsorbovanog gasa na ~vrstoj
povr{ini raste sa smanjenjem temperature sistema. Na osnovu Le
[atelije-Braunovog (Le Chatelier-Braun) principa mo`e se zaklju~iti
da je adsorpcija gasova egzoterman proces. Adsorpcija te~nih rast-
vora na ~vrstom adsorbensu mo`e biti egzoterman ili endoterman
proces. Pri adsorpciji gasova na ~vrstim povr{inama razlikuju se
fizi~ka
i
hemijska adsorpcija
(
hemisorpcija
). Fizi~ka adsorpcija se
zasniva na Van der Valsovim (van der Waals) silama, pa se usled toga
mo`e stvoriti vi{emolekulski sloj adsorbata na povr{ini adsorbensa.
Kod hemisorpcije dolazi do stvaranja hemijskih veza, zbog ~ega se
na povr{ini adsorbensa obrazuje monomolekulski sloj adsorbata. U
mnogim slu~ajevima adsorpcija je delimi~no i fizi~ka i hemijska. Ta-
kav primer je adsorpcija kiseonika na aktivnom uglju. Od ukupne
koli~ine adsorbovanog kiseonika, samo onaj deo koji je vezan fizi~-
kim silama mo`e se desorbovati pomo}u vakuuma. Preostali deo je
hemijski vezan kao ugljen-monoksid i ugljen-dioksid i mo`e se sa-
mo delimi~no desorbovati.
Zavisnost adsorbovane koli~ine gasa od pritiska gasa data je
Frojndlihovom
(Freundlich)
adsorpcionom izotermom
:
gde je:
x – koli~ina adsorbovanog gasa u molovima
m – masa adsorbensa
P – ravnote`ni pritisak gasa
K, n – karakteristi~ne konstante koje zavise od sistema adsor-
bens/adsorbat i temperature.
Jedna~ina (2) mo`e se primeniti i na adsorpciju supstancije iz vr-
lo razbla`enih rastvora, s tim {to se pritisak zamenjuje ravnote`nom
koncentracijom adsorbuju}e supstancije. Na dijagramu (slika 2) vi-
di se da adsorbovana koli~ina gasa u po~etku, pri malim pritiscima,
brzo raste, a zatim se polako pribli`ava nekoj grani~noj maksimal-
noj vrednosti, {to se obja{njava time da je povr{ina adsorbensa za-
si}ena molekulima gasa.
Eksperimentalna fizi~ka hemija
229
= K . P
1
/n
x
m
(2)
Slika 2.
Frojndlihova adsorpciona izoterma
Medenica / Male{ev
230
Logaritmovanjem jedna~ine (2) dobija se izraz:
koji predstavlja pravu prikazanu dijagramom (slika 3). Iz odse~ka
prave na ordinati (log K) izra~unava se konstanta
K
, a iz nagiba
(1/n) konstanta
n
.
log
= log
K +
log
P
x
m
1
n
(3)
Slika 3.
Logaritamski oblik
Frojndlihove adsorpcione izoterme

Medenica / Male{ev
232
REZULTATI
Tabela 1.
Odre|ivanje broja kapi u stalagmometru
c (mol L
–1
)
A
B
C
D
E
F (n)
< n >
A – broj podeoka koje zauzima jedna kap
B – broj podeoka iznad pro{irenja
C – broj podeoka ispod pro{irenja
D – ukupan broj kapi
E – broj kapi u vi{ku zapremine
[
(B + C) / A
]
F – broj kapi u pro{irenom delu stalagmometra (n) (n = D – E)
voda
Eksperimentalna fizi~ka hemija
233
R = 8,314 J K
–1
mol
–1
T = .........K
σ
H
2
O
= ..........N . m
–1
(tablica 3 u Prilogu)
Tabela 2.
Gibzova adsorpciona izoterma
c (mol L
–1
)
σ
(N m
–1
)
∆σ
/
∆
c
<
∆σ
/
∆
c>
Γ
(mol m
–2
)

Eksperimentalna fizi~ka hemija
235
Primer za izra~unavanje x/m
a)
Za titraciju 10 mL pripremljene 0,1 mol L
–1
sir}etne kiseline pre
adsorpcije utro{eno je 10,15 mL 0,1 mol L
–1
rastvora natrijum-hi-
droksida. Koncentracija ove kiseline je:
c
1
× V
1
= c
2
× V
2
0,1 mol L
–1
× 10,15 mL = c
2
× 10 mL
c
2
= 0,1015 mol L
–1
b)
Za adsorpciju 100 mL 0,1015 mol L
–1
sir}etne kiseline odmereno
je 1,0250 g aktivnog uglja (m = 1,025×10
-3
kg).
Posle adsorpcije, za titraciju 10 mL sir}etne kiseline, utro{eno je
8,50 mL 0,1 mol L
–1
rastvora natrijum-hidroksida. To zna~i da je
koncentracija sir}etne kiseline posle adsorpcije c = 0,085 mol L
–1
.
Razlika u koncentracijama sir}etne kiseline pre i posle adsorpcije
iznosi 0,0165 mol L
–1
, {to zna~i da bi adsorbovana koli~ina kiseline
iznosila 0,0165 molova, da je za adsorpciju uzet 1 L kiseline. S obzi-
rom na to da je adsorpcija izvr{ena sa 100 mL kiseline, adsorbovana
koli~ina
x
iznosi 0,00165 molova.
Odnos
x/m
je:
0,00165 molova : 1,025 g = 1,61 mol kg
–1
a log x/m:
log x/m = 0,207
Rezultate prikazati tabelarno i grafi~ki.
Medenica / Male{ev
236
t = .........°C
Broj probe
Pre adsorpcije
Posle adsorpcije
V NaOH (mL)
c
kis.
(mol L
–1
)
V NaOH (mL)
c
kis.
(mol L
–1
)
Tabela 1.
Titracija acetatne kiseline sa 0,1 mol L
–1
NaOH
Tabela 2.
Frojndlihova adsorpciona izoterma
Proba
m (kg)
c (mol L
–1
)
log c
x(mol)
x/m (mol kg
–1
)
log x/m
log x/m = log K + 1/n log c
K
n
Tabela 3.
Konstante Frojndlihove adsorpcione izoterme
t = .........°C
REZULTATI
V
kis.
=.............mL

Hromatografija
je postupak koji omogu}ava razdvajanje, izolovanje,
identifikaciju i odre|ivanje sastojaka sme{e na osnovu procesa koji
se de{avaju na granici dve faze koje se ne me{aju. Jedna faza je sta-
cionarna i mo`e biti porozno ili granulisano ~vrsto telo, te~nost,
tanak sloj te~nosti adsorbovan na ~vrstom telu i jonoizmenjiva~.
Druga faza je mobilna i mo`e biti gas ili te~nost.
Hromatografski proces sastoji se u tome {to se rastvor sme{e u
mobilnoj fazi propu{ta kroz stacionarnu fazu, pri ~emu dolazi do
raspodele komponenata sme{e izme|u mobilne i stacionarne faze.
Ovaj prelazak komponente iz jedne u drugu fazu de{ava}e se sve dok
odnos koncentracija komponente u stacionarnoj (c
s
) i mobilnoj fazi
(c
m
) ne dostigne konstantnu vrednost, koja se naziva
koeficijent
raspodele
a izra`en je Nernstovim (Nernst) zakonom raspodele:
Koeficijent raspodele zavisi od osobina faza, afiniteta komponente
prema fazama i temperature.
Razdvajanje supstancija uzrokovano je fizi~kohemijskim proces-
ima kao {to su adsorpcija, razli~ita raspodela (rastvorljivost) sastoja-
ka sme{e izme|u dve te~ne faze i jonska izmena. Prema ovim pro-
cesima hromatografija se deli na:
o
adsorpcionu,
o
podeonu (particionu) i
o
jonoizmenjiva~ku.
Podela hromatografskih metoda mo`e se izvr{iti i na druge na-
~ine koji zavise od postavljenih kriterijuma: agregatnog stanja mo-
bilne i stacionarne faze, na~ina pomeranja faza i tehnike izvo|enja
hromatografije.
Eksperimentalna fizi~ka hemija
239
HROMATOGRAFIJA
(gr~ki
chroma
– boja i
graphein
– pisati)
Teorijski princip
K =
c
s
c
m
(1)
Zasniva se na procesima adsorpcije rastvorene supstancije na grani-
ci faza ~vrsto/te~no. Kao stacionarna faza koriste se ~vrste supstanci-
je, koje predstavljaju dobar adsorbens za komponente analizirane
sme{e (slika 1). Naj~e{}e se koriste
aluminijum
-
oksid
,
silikagel
,
mag-
nezijum
-s
ilikat
,
magnezijum
-
oksid
, a re|e
aktivni ugalj
. Dobrim ad-
sorbensima smatraju se supstancije koje su porozne, {to zna~i da
imaju veliku aktivnu povr{inu. Mehanizam adsorpcije se zasniva na
fizi~kim i hemijskim vezama izme|u adsorbensa i adsorbata, {to je
detaljnije obja{njeno u poglavlju »Procesi na granici faza«.
Punjenje kolone vr{i se tako {to se adsorbens u granulama, koje
moraju biti pribli`no istog pre~nika, oslobodi od sopstvenog praha i
suspenduje u rastvara~u koji se kasnije koristi kao mobilna faza.
Suspenzija se polako sipa u kolonu koja je prethodno do jedne tre-
}ine napunjena istim rastvara~em. Slavina na koloni se delimi~no
otvori tako da rastvara~ isti~e u kapima. Time se adsorbens izdvaja
iz suspenzije i sle`e u koloni.
Prema na~inu razdvajanja komponenti iz sme{e razlikuju se
slede}e metode:
o
frontalne analize
o
istiskivanja
o
eluiranja
Sastoji se u tome da se ispitivana sme{a kontinuirano propu{ta kroz
kolonu. Ako sme{a sadr`i komponente A, B i C sa redosledom koefi-
cijenata raspodele K
A
> K
B
> K
C
, iz kolone prvo izlazi ~ista kompo-
nenta C, jer se najslabije adsorbuje. Zatim izlazi sme{a komponena-
ta B i C i na kraju eluat koji sadr`i komponente A, B i C u istom
odnosu u kome su unete u kolonu. Ovom metodom mo`e se dobiti
samo deo ~iste komponente C, odnosno ona koja se prva izdvaja iz
kolone, pa ova metoda nema ve}i analiti~ki zna~aj.
Izvodi se tako {to se mala koli~ina sme{e, koja sadr`i komponente A,
B i C, nanese na vrh kolone. Zatim se kroz kolonu kontinuirano
propu{ta rastvor komponente D, koja se mnogo ja~e vezuje za ad-
sorbens od komponenata analizirane sme{e. Komponenta D po-
tiskuje komponente sme{e, koje obrazuju zone. Zbog stalnog dejstva
komponente D, komponente sme{e se ne mogu potpuno razdvojiti,
ve} se zone me|usobno dodiruju. Do izlaska iz kolone, sve tri zone
se kre}u istom brzinom, a po{to izme|u njih nema razmaka, metoda
se ne mo`e pouzdano koristiti za razdvajanje u analiti~ke svrhe.
Medenica / Male{ev
240
Adsorpciona
hromatografija
u koloni
Slika 1.
Adsorpciona hromatografija u koloni
Metoda frontalne analize
Metoda istiskivanja

Medenica / Male{ev
242
Zasniva se na raspodeli (razli~itoj rastvorljivosti) supstancija izme-
|u dve te~ne faze koje se me|usobno ne me{aju. Jedna te~nost je sta-
cionarna faza vezana za ~vrst nosa~, a druga je mobilna faza. Pored
procesa koji se zasniva na razli~itoj rastvorljivosti, de{ava se delimi~-
no i proces adsorpcije na ~vrstom nosa~u. Deli se na:
o
podeonu hromatografiju u koloni i
o
podeonu hromatografiju na hartiji i na tankom sloju.
Koeficijent raspodele u podeonoj hromatografiji naziva se
pode-
oni koeficijent
α
. Karakteristi~an je za sistem u kome postoji kon-
centraciona ravnote`a nekog jedinjenja izme|u dva odre|ena rast-
vara~a, pri konstantnim vrednostima pritiska i temperature.
Kolona se priprema na sli~an na~in kao kod adsorpcione hroma-
tografije, s tim {to je vezana stacionarna faza naj~e{}e voda, a mobil-
na su organski rastvara~i koji se ne me{aju sa vodom.
Za kvalitativnu i kvantitativnu analizu sme{e, kao i u adsorpcio-
noj hromatografiji, uglavnom se koristi metoda eluiranja. Na pri-
mer, sme{a aminokiselina mo`e se analizirati u koloni sa silikagelom
koji je nosa~ stacionarne faze – vode, a mobilnu fazu ~ini neki or-
ganski rastvara~.
Naziva se i hromatografija u »otvorenoj koloni«. Razdvajanje kom-
ponenata vr{i se na hartiji ili plo~ici preko koje je nanet tanak sloj
~vrstog adsorbensa. Protok mobilne faze kroz hartiju ili tanak sloj
ostvaruje se kapilarnim prodiranjem kroz poroznu sredinu. Brzine
kretanja tzv.
zona
ili
mrlja
, od kojih svaka predstavlja jednu izdvo-
jenu komponentu, veoma su va`ne za hromatografski proces, jer od
njih zavisi razdvajanje komponenata. Brzina mobilne faze zavisi, pre
svega, od veli~ine pora u hartiji, odnosno pre~nika ~estica ~vrstog
adsorbensa.
Pri horizontalnom protoku rastvara~a (mobilne faze), tj. kada na
molekule rastvara~a deluju samo kapilarne sile, a ne i sila gravitacije,
front rastvara~a pre}i }e rastojanje
z
:
gde je:
k – konstanta koja zavisi od prirode sistema (povr{inski napon i vis
koznost) i temperature
t – vreme za koje rastvara~ pre|e put
z
.
Podeona (particiona)
hromatografija
Podeona hromatografija
u koloni
Podeona hromatografija
na hartiji i na tankom sloju
z = (k . t)
1/2
(2)
Eksperimentalna fizi~ka hemija
243
Kod uzlazne ili silazne tehnike razdvajanja, gravitaciona sila sma-
njuje, odnosno pove}ava brzinu kretanja rastvara~a, pa tako uti~e i
na pre|eni put fronta
z
. Da bi se dobilo dobro razdvajanje, potrebno
je uskladiti vrstu tehnike, vrstu hartije ili tankog sloja, sastav mo-
bilne faze, du`inu trake od hartije, du`inu plo~ice sa tankim slojem i
drugo.
Va`na veli~ina u podeonoj hromatografiji je
R
f
vrednost
(reten-
cioni faktor ili faktor zadr`avanja), koja je karakteristi~na za svaku
komponentu u definisanom hromatografskom sistemu i slu`i za
identifikaciju komponente u analiziranoj sme{i. Defini{e se kao od-
nos pre|enog puta komponente (a) i pre|enog puta rastvara~a (b):
Merenje puteva vr{i se od sredi{ta zone nanetog uzorka (anal-
izirane sme{e), koje se zove startna linija, do sredi{ta zone kompo-
nente, odnosno do fronta rastvara~a, kao {to je prikazano na slici 3.
Najve}u R
f
vrednost ima}e komponenta koja se najbolje rastvara
u organskom rastvara~u (mobilnoj fazi), jer se br`e kre}e od kom-
ponente koja se bolje rastvara u stacionarnoj fazi. Smatra se da su
komponente dobro razdvojene ako je
∆
R
f
> 0,05.
Izvodi se u staklenoj posudi, odnosno kadi sa poklopcem koji se do-
bro zatvara. Time se atmosfera posude odr`ava zasi}enom parama
rastvara~a, ~ime se spre~ava njegovo isparavanje sa hartije. [irina
zone izdvojene komponente zavisi od {irine po~etne zone uzorka i
koncentracije uzorka. Pomo}u kalibrisane kapilare ili mikropipete
nanese se rastvor uzorka na nekoliko centimetara od kraja trake od
hartije, koja se nalazi u horizontalnom polo`aju. Uzorak se nanosi u
obliku zone, koja ne treba da ima pre~nik ve}i od 5 mm, ili u obliku
{to tanje crte. Ako je koncentracija uzorka velika, uzorak se pre na-
no{enja razbla`i, a ako je mala, uzorak se nanosi vi{e puta na isto
mesto, s tim {to se pre svakog nano{enja, prethodno naneta zona
mora osu{iti na vazduhu ili u struji ne suvi{e toplog vazduha.
Hartija sa nanetom zonom uzorka mo`e se postaviti u sud tako
da rastvara~ kroz hartiju prolazi horizontalno, nadole ili nagore.
Prema tome, razlikuju se:
o
horizontalna (kru`na),
o
silazna i
o
uzlazna tehnika.
R
f
=
a
b
(3)
Slika 3.
Odre|ivanje R
f
vrednosti
S – start
R – front rastvara~a
a, b, c – pre|eni putevi komponenata
A, B i C
d – pre|eni put rastvara~a
A. Podeona hromatografija
na hartiji

Eksperimentalna fizi~ka hemija
245
Dvodimenzionalna tehnika
je poseban vid tehnike i koristi se kod
supstancija sa bliskim Rf vrednostima. Kad se zavr{i razdvajanje si-
laznom tehnikom, traka se osu{i, okrene za 90° i protok rastvara~a,
naj~e{}e nekog drugog, usmeri normalno na pravac kretanja prvog
rastvara~a (slika 7). Na taj na~in razdvajaju se komponente koje se
nisu prvobitno razdvojile. Da bi dvodimenzionalno razdvajanje us-
pelo, potrebno je da prethodni rastvara~ potpuno ispari ili da bude
hemijski inertan u odnosu na drugi rastvara~.
Razvijanje hromatograma
podrazumeva proces razdvajanja kom-
ponenata na hromatografskoj hartiji. Proces je zavr{en kad front
rastvara~a do|e do unapred odre|ene du`ine ili kad pro|e prethod-
no izmereno vreme razdvajanja komponenata. Olovkom se zabele`i
front rastvara~a, a zatim se hartija osu{i na vazduhu ili u struji toplog
vazduha, koja se propu{ta paralelno sa pravcem prostiranja trake.
Odre|ivanje polo`aja zona
podrazumeva primenu hemijskih ili fi-
zi~kih procesa da bi se zone hromatograma u~inile vidljivim. Fluo-
rescentne supstancije otkrivaju se pomo}u UV lampe, a polo`aj zona
radioaktivnih supstancija odre|uje se ure|ajem za merenje radio-
aktivnosti. U drugim slu~ajevima se, za detekciju zona, naj~e{}e ko-
risti hemijska metoda koja se sastoji u tome da se osu{ena traka prska
odgovaraju}im rastvorom koji hemijski reaguje sa zonama, daju}i
obojena jedinjenja.
Slika 7.
Dvodimenzionalna tehnika
Medenica / Male{ev
246
Kvalitativna analiza
komponenata izvodi se odre|ivanjem R
f
vred-
nosti i njihovim pore|enjem sa tabli~nim. Ovaj na~in nije dovoljno
pouzdan, jer R
f
vrednost zavisi od vi{e faktora, kao {to su priroda
komponenti, sastav mobilne faze, temperatura, vrsta hartije i dr. Za-
to se pri publikovanju R
f
vrednosti moraju definisati i uslovi pod
kojima su one odre|ene. Pouzdaniji na~in identifikacije sastoji se u
tome da se ise~e deo hartije sa zonom nepoznate supstancije i izvr{i
ekstrakcija zone pogodnim rastvara~em. Dobijeni rastvor mo`e se
ispitati hemijskim, fizi~kohemijskim metodama ili hromatografski,
pore|enjem sa hromatogramima referentnih supstancija.
Kvantitativna analiza
komponenata mo`e se izvr{iti na dva na~ina:
direktnim odre|ivanjem koli~ine supstancije u zoni ili ekstrakcijom
supstancije iz zone pogodnim rastvara~em. Supstancije se odre|uju
u izdvojenim zonama direktno na hartiji (
in situ
) spektrofotometri-
jskim metodama, uglavnom na osnovu reflektovane svetlosti. Drugi
na~in se odnosi na hemijsko i fizi~kohemijsko odre|ivanje koli~ine
supstancije u rastvoru dobijenog ekstrakta.
Izvodi se istim tehnikama kao i hromatografija na hartiji:
horizon-
talnom
,
silaznom
i
uzlaznom
. Aparatura za razvijanje hromatograf-
skih plo~a prikazana je na slici 8.
Da bi se dobila ravnomerna zasi}enost parom u svim delovima
komore, unutra{nji zidovi se obla`u filtar-hartijom natopljenom
rastvara~em, koji slu`i kao mobilna faza.
B. Podeona hromatografija
na tankom sloju
Slika 8.
Komore za razvijanje hromatografskih
plo~a (shematski prikaz)
(a – silazna; b – uzlazna; c – horizon-
talna tehnika)

Kvalitativna analiza
razdvojenih komponenti, odnosno identi-
fikacija, mo`e se izvr{iti odre|ivanjem R
f
vrednosti, ali je ova meto-
da jo{ manje pouzdana od one kod hromatografije na hartiji. Uzrok
le`i u dodatnim faktorima koji uti~u na kretanje zona, kao {to su
priroda, aktivnost i debljina sloja adsorbensa, kao i zasi}enost at-
mosfere komore parama rastvara~a. Ako se supstancija ne mo`e sa
sigurno{}u identifikovati pomo}u R
f
vrednosti ili bojenim reakcija-
ma, sloj adsorbensa sa zonom supstancije pa`ljivo se skine sa plo~e,
zona se ekstrahuje pogodnim rastvara~em i odre|uje nekom od
fizi~kohemijskih metoda.
Kvantitativna analiza
se mo`e vr{iti direktno na plo~i spektrofo-
tometrijskim metodama, uglavnom na osnovu merenja intenziteta
reflektovane svetlosti, pod uslovom da su zone obojene, da fluoresci-
raju ili reaguju sa pogodnim reagensom, daju}i obojeno jedinjenje.
Ako se zona skida zajedno sa slojem adsorbensa, onda se analiza vr{i
nekom klasi~nom kvantitativnom metodom.
Hromatografija na hartiji i na tankom sloju ima veliku primenu
u istra`iva~kim i rutinskim odre|ivanjima. Sa razvojem hromato-
grafije na tankom sloju, kao i gasne, odnosno te~ne hromatografije,
smanjena je primena hromatografije na hartiji. Tankoslojna hro-
matografija na{la je {iroku primenu u farmaciji. U ispitivanju i kon-
troli lekova primenjuje se kako u analizi polaznih sirovina, tako i
me|uproizvoda i finalnih proizvoda. Tako|e se koristi i u pra}enju
stabilnosti lekova, zatim za odvajanje i odre|ivanje aktivnih princi-
pa lekova i njihovih degradacionih proizvoda. Ova metoda se mo`e
primeniti i na lek i na biolo{ki materijal. U biohemijskim i farmako-
lo{kim ispitivanjima primenjuje se za odre|ivanje metabolita lekova
u telesnim te~nostima. U analizi `ivotnih namirnica koristi se za
odre|ivanje npr. ostataka pesticida, za odvajanje i identifikaciju
aminokiselina ili za odre|ivanje boja koje se koriste kao aditivi. U
toksikolo{kim analizama koristi se za odre|ivanje npr. insekticida u
razli~itim materijalima.
Ovde su pomenuti samo neki karakteristi~ni primeri primene
tankoslojne hromatografije u farmaciji.
Medenica / Male{ev
248
Zasniva se na razlikama u afinitetu jonskih vrsta u rastvoru prema
izmeni sa jonima aktivnih grupa koje poseduju neki adsorbensi.
Takvi adsorbensi mogu biti neorganskog i organskog porekla, sin-
teti~ki i prirodni. Prema tome da li u aktivnim grupama sadr`e mo-
bilne katjone ili anjone, dele se na
katjonske
i
anjonske izmenji-
va~e
. Primena jonskih izmenjiva~a u analiti~ke svrhe je razli~ita:
razdvajanje elemenata sli~nog hemijskog pona{anja (npr. lantanida i
aktinida), odvajanje jonskih od nejonskih vrsta, razdvajanje jona,
razdvajanje katjona od anjona, koncentrisanje jona metala iz vrlo
razbla`enih rastvora i odre|ivanje koncentracije.
U praksi se, uglavnom, koriste visokopolimerne smole koje sa-
dr`e aktivne kiselinske ili bazne grupe, ~iji se joni izmenjuju sa joni-
ma iz rastvora. Katjonski izmenjiva~i sadr`e kiselinske grupe, kao
{to su –SO
3
H i –COOH, a anjonski izmenjiva~i sadr`e bazne grupe,
kao {to su –OH ili amino grupe –NH
2
, –NHR i –NR
2
. Mehanizam
izmene katjona izme|u katjonskog izmenjiva~a i analiziranog rast-
vora, npr. NaCl, zasniva se na ravnote`noj reakciji:
R–SO
3
H + NaCl
R–SO
3
Na + HCl
a mehanizam izmene anjona izme|u anjonskog izmenjiva~a i rast-
vora NaCl:
R–OH + NaCl
R–Cl + NaOH
Jonoizmenjiva~ka hromatografija se naj~e{}e izvodi u koloni, ko-
ja se mo`e puniti raznim vrstama organskih katjonskih i anjonskih
izmenjiva~kih smola (slika 9). Suspenzija izmenjiva~a u vodi sipa se
u kolonu koja je delimi~no napunjena vodom, pri ~emu treba paziti
da u kolonu ne u|e vazduh. Na kraju se ispusti vi{ak vode, ali tako
da iznad smole uvek mora postojati sloj te~nosti, bez obzira da li je
kolona u pripremi ili je u toku jonska izmena.
Pri prvom kori{}enju izmenjiva~i nisu dovoljno ~isti za anali-
ti~ke svrhe, pa ih je potrebno
pre~istiti
. Katjonski izmenjiva~i se vi{e
puta naizmeni~no ispiraju sa: 2 mol L
–1
HCl, destilovanom vodom,
2 mol L
–1
NaCl i ponovo destilovanom vodom. Ako je potreban iz-
menjiva~ u H–obliku, poslednje ispiranje se vr{i kiselinom, a kad se
`eli Na–oblik, poslednji se propu{ta NaCl. Na kraju se izmenjiva~
ispira destilovanom vodom do negativne reakcije na odgovaraju}i
jon (H
+
ili Na
+
). Anjonski izmenjiva~i se naizmeni~no ispiraju sa:
2 mol L
–1
NaCl, destilovanom vodom, 2 mol L
–1
NaOH i ponovo
Eksperimentalna fizi~ka hemija
249
Jonoizmenjiva~ka
hromatografija
Slika 9.
Kolona sa smolom

Razdvajanje jona u koloni vr{i se na osnovu afiniteta odre|enih
jona prema smoli. Afinitet zavisi od vi{e faktora. U vodenim rastvo-
rima afinitet prema smoli raste sa pove}anjem naelektrisanja jona.
Ako razli~ite jonske vrste imaju jednaka naelektrisanja, ve}i afinitet
prema smoli ima jon manjeg radijusa.
Kvalitativna analiza se naj~e{}e vr{i metodom eluiranja. Ako se
na vrh kolone sa anjonskom smolom sipa odre|ena zapremina anali-
zirane sme{e kiselina, a zatim vr{i eluiranje vodom, u gornjem delu
kolone do}i }e do izmene anjona smole sa anjonom ja~e kiseline,
prema kojoj smola ima najve}i afinitet. Zatim }e se izmeniti slabija
kiselina, pa ostale. Na ovaj na~in posti`e se razdvajanje kiselina u an-
jonskim i baza u katjonskim izmenjiva~ima, ~ija razlika u pK vred-
nostima mo`e biti manja od 0,05 jedinica.
Kvantitativna analiza
se vr{i tako {to se odre|ena zapremina
analiziranog rastvora sipa na vrh kolone, a zatim vr{i sporo eluiranje
vodom da bi se izvr{ila kvantitativna izmena jona. Ako se u katjon-
skom izmenjiva~u odre|uje koncentracija rastvora NaCl, u eluatu }e
se, prema prikazanoj reakciji izmene katjona, na}i ekvivalentna koli-
~ina HCl. Eluiranje vodom vr{i se do neutralne reakcije, {to se pro-
verava lakmus-trakom. Eluat sa HCl, sakupljen u erlenmajeru, titruje
se rastvorom NaOH poznate koncentracije uz metiloran` kao indi-
katorom. Iz utro{ene zapremine NaOH i poznate zapremine anali-
ziranog NaCl, izra~unava se koncentracija NaCl, prema izrazu:
gde je:
M – koncentracija u mol L
–1
V – zapremina rastvora.
U slu~aju da se rastvor NaCl propu{ta kroz anjonski izmenjiva~,
u eluatu }e biti NaOH, a kao titrant koristi}e se rastvor HCl poznate
koncentracije.
Upotrebljene smole mogu se
regenerisati
i vi{e stotina puta, a da
ne do|e do smanjenja kapaciteta. Regenerisanje katjonskih smola
vr{i se sa 2 mol L
–1
hloridnom kiselinom, a anjonskih sa 2 mol L
–1
natrijum-hidroksidom, da bi se aktivne grupe ponovo zasitile aktiv-
nim jonima. Eluiranje pomo}u kiseline, odnosno baze izvodi se vi{e
puta, a zatim se ispira destilovanom vodom do neutralne reakcije.
Eksperimentalna fizi~ka hemija
251
M
NaCl
=
M
NaOH
.V
NaOH
V
NaCl
(5)
Jedna od najva`nijih primena smola za izmenu jona je pre~i{}a-
vanje vode tzv. »hladnim postupkom« bez destilacije. Tako se dobija
dejonizovana voda koja je ~esto boljeg kvaliteta nego ona dobijena
klasi~nom destilacijom. Postupak se sastoji u propu{tanju vode prvo
kroz jak katjonski, zatim kroz jak anjonski izmenjiva~ i na kraju kroz
kolonu sa sme{om anjonskog i katjonskog izmenjiva~a. Jonski iz-
menjiva~i se veoma uspe{no koriste i za pre~i{}avanje radioaktivnih
voda.
Pomo}u katjonskih izmenjiva~a razdvajaju se aminokiseline,
masne kiseline, kiseline od baza, koje su rastvorne u vodi. Anjonski
izmenjiva~i se koriste za razdvajanje alkaloida, hlorofenola, hemo-
globina, aldehida, ketona, organskih kiselina male molarne mase i
drugo.
Medenica / Male{ev
252

Pribor i hemikalije
l
Komora za hromatografiju (slika 8)
l
Plo~ica sa tankim slojem od silikagela
l
Sme{a organskih rastvara~a (mobilna faza)
l
Analizirana sme{a za razdvajanje
Priprema
Komoru za hromatografiju pripremiti kao {to je prikazano na slici 8.
Zidove komore oblo`iti filtar-hartijom natopljenom mobilnom fa-
zom, da bi atmosfera komore bila ravnomerno zasi}ena parama
rastvara~a. U komoru zatim sipati rastvara~ (mobilna faza) tako da
pokrije dno i poklopiti komoru.
Postupak
Na jedan kraj plo~ice sa tankim slojem od silikagela naneti jednu
kap sme{e i centar dobijene mrlje ozna~iti kao start. Plo~icu postavi-
ti u komoru tako da se mrlja nalazi nekoliko milimetara iznad nivoa
rastvara~a. Kada rastvara~ do|e skoro do kraja plo~ice, izvaditi plo-
~icu iz komore i obele`iti front rastvara~a. Na osu{enoj plo~ici obe-
le`iti centre mrlja koje su se razdvojile i izra~unati njihove R
f
vred-
nosti.
Grafi~ki prikazati dobijeni hromatogram na tankom sloju.
Medenica / Male{ev
254
URADITE SAMOSTALNO...
Podeona
hromatografija na
tankom sloju
Zadatak eksperimenta
n
Podeonom hromatografijom razdvojiti komponente iz
analizirane sme{e i izra~unati njihove R
f
vrednosti.
Grafi~ki prikazati dobijeni hromatogram.
Aparatura i hemikalije
l
Kolona sa katjonskom smolom Dowex-50 (slika 9)
l
Hloridna kiselina
l
Natrijum-hlorid
l
Natrijum-hidroksid
l
Destilovana voda
l
Metiloran`
Priprema
a) Punjenje kolone
Kolonu sa smolom pripremiti kao {to je prikazano na slici 9. Dno
kolone zatvoriti sinterovanom plo~icom ili staklenom vunom, a za-
tim napuniti kolonu smolom. Kolona se priprema tako {to se vode-
na suspenzija smole uliva u kolonu, pri ~emu treba voditi ra~una da
u koloni ne ostanu mehuri}i vazduha. Smolu treba prethodno os-
taviti neko vreme da bubri u vodi. Vrh kolone u~vrstiti sa malo stak-
lene vune. Iznad smole uvek mora postojati sloj te~nosti.
b) Regenerisanje smole
Kroz kolonu sa katjonskim izmenjiva~em propustiti rastvor hlorid-
ne kiseline, a zatim ispirati destilovanom vodom do neutralne reak-
cije, koja se proverava lakmus-trakom.
Eksperimentalna fizi~ka hemija
255
URADITE SAMOSTALNO ...
Jonoizmenjiva~ka
hromatografija
Zadatak eksperimenta
n
Regenerisati smolu.
n
Odrediti kapacitet smole.
n
Odrediti koncentraciju rastvora natrijum-hlorida.

Eksperimentalna fizi~ka hemija
257
REZULTATI
Tabela 1.
Odre|ivanje kapaciteta smole (C) i koncentracije (c)
rastvora natrijum-hlorida
C
smole
(mmol g
–1
)
V NaCl (mL)
c NaOH (mol L
–1
)
V NaOH (mL)
c NaCl (mol L
–1
)
Pojava usmerenog kretanja koloidnih i drugih naelektrisanih ~estica
u polju jednosmernog elektri~nog napona naziva se
elektroforeza
.
To je elektromigraciona metoda koja spada u grupu osetljivih meto-
da separacije. Koristi se za kvalitativnu i kvantitativnu analizu pravih
(jonoforeza) ili koloidnih rastvora (elektroforeza), ali je usvojen je-
dinstven naziv elektroforeza.
Razdvajanje komponenata iz analizirane sme{e izvodi se na os-
novu razli~itog predznaka naelektrisanja ~estica. Ako ~estice kom-
ponenata imaju isti predznak naelektrisanja, onda se razdvajanje
vr{i na osnovu razli~ite pokretljivosti, koja zavisi od koli~ine naelek-
trisanja i veli~ine ~estica. Jonska pokretljivost ~estica zavisi i od elek-
tri~nog polja izme|u dve elektrode, koje su povezane sa izvorom
jednosmerne struje. Elektri~na sila
F
1
, koja izaziva kretanje ~estice,
jednaka je proizvodu koli~ine naelektrisanja ~estice
Q
i ja~ine elek-
tri~nog polja
E
:
Ja~ina elektri~nog polja defini{e se kao odnos razlike potencijala
i rastojanja izme|u elektroda.
Na jon ili naelektrisanu koloidnu ~esticu u kretanju deluje i sila
trenja
F
2
, koja se suprotstavlja kretanju ~estica. Ona zavisi od vis-
koznosti sredine
η
, polupre~nika ~estice
r
i brzine kretanja ~estice
v
:
Kad se ~estica na|e u elektri~nom polju, u po~etku se kre}e spo-
ro, a zatim sve br`e, pri ~emu raste
F
2
prema jedna~ini (2). Kad se
sile izjedna~e:
~estica se dalje kre}e nekom konstantnom brzinom v, koja se izra~u-
nava iz jedna~ina (1), (2) i (3):
Eksperimentalna fizi~ka hemija
259
ELEKTROFOREZA
Teorijski princip
F
1
= Q . E
(1)
F
2
=
6
π
.
η
. r . v
(2)
F
1
= F
2
(3)
v =
Q . E
6
π
.
η
. r
(4)

Kao podloga za analiziranu sme{u koristi se filtar-hartija, a u po-
slednje vreme celuloza-acetat, ~ija je struktura homogenija, pa se
dobijaju br`a i bolja razdvajanja. U upotrebi su i druge vrste podlo-
ga, kao {to su agar-gel, silikagel, jonske izmenjiva~ke smole, a poseb-
no gelovi poliakrilamida i amidona zbog njihove velike mo}i razd-
vajanja.
Katodni i anodni prostor ure|aja za elektroforezu ispunjeni su
rastvorom elektrolita, odnosno pufera, ~ija vrednost pH i jonska ja-
~ina zavise od prirode analizirane sme{e. Krajevi trake su uronjeni u
rastvor pufera, koji putem kapilarnog kretanja kvasi celu traku i
omogu}ava protok struje izme|u elektroda.
Razdvajanje sme{e, koja je prethodno naneta na podlogu, izvodi
se pri unapred utvr|enim vrednostima ja~ine struje i napona, kao i
vremena trajanja elektroforeze. Elektroforetsko pomeranje ~estica,
koje zavisi od ovih karakteristika, mo`e se izra~unati ili odrediti ek-
sperimentalnim putem. Po zavr{etku elektroforeze, podloga se su{i,
a razdvojene zone mogu se otkriti posmatranjem pod UV lampom
ili kva{enjem odgovaraju}im reagensima koji daju bojene reakcije.
Koncentracije pojedinih komponenti odre|uju se tako {to se ise~ene
zone rastvore u pogodnom rastvara~u, a dobijeni rastvori odre|uju
fotometrijski.
Eksperimentalna fizi~ka hemija
261
Slika 1.
Ure|aj za elektroforezu
S – izvor naizmeni~ne struje
T – ispravlja~
R – otpornik
A – ampermetar
V – voltmetar
E – kada za elektroforezu
k – katodni prostor
a – anodni prostor
Medenica / Male{ev
262
Elektri~ne osobine koloidnih i drugih ~estica zavise od pH rast-
vora, koji treba tako podesiti da joni postignu maksimalnu pokret-
ljivost. Slabe kiseline disosuju u baznoj sredini, pri ~emu nastaju
molekulski anjoni, dok slabe baze disosuju u kiseloj sredini, daju}i
molekulske katjone. Neki amfoterni makromolekuli, kao {to su be-
lan~evine, poseduju aktivne bo~ne grupe, koje mogu biti pozitivno
ili negativno naelektrisane u zavisnosti od pH rastvora. Pri odre|enoj
pH vrednosti mo`e do}i do izjedna~enja broja pozitivnih i nega-
tivnih naelektrisanja u makromolekulu, tako da je ukupno naelek-
trisanje molekula jednako nuli. Ta pH vrednost naziva se
izoelek-
tri~na ta~ka
, pri kojoj se molekuli ne kre}u u elektri~nom polju, pa
im je pokretljivost jednaka nuli (u = 0).
Jonska ja~ina i jonska sredina rastvora pufera uti~u na ja~inu
elektri~nog polja i pokretljivost analiziranih ~estica. Velika koncen-
tracija jona smanjuje ja~inu elektri~nog polja i pokretljivost ~estica,
pa je elektroforeza produ`ena. Razdvajanje pri jonskoj ja~ini jed-
nakoj nuli nije mogu}e, jer je neophodna izvesna koncentracija elek-
trolita radi odr`avanja elektri~ne provodljivosti rastvora. S druge
strane, odsustvo jona pove}ava mogu}nost koagulacije koloidnih
~estica i talo`enja makromolekula ili njihovo spajanje u aglomerate.
Zbog toga se radi sa puferima, ~ija se jonska ja~ina nalazi u intervalu
0,05 do 0,1 mol L
–1
.
Jonska sredina podrazumeva odgovaraju}u prirodu rastvara~a i
elektrolita. [to je ve}a polarnost rastvara~a, manja je sila uzajamnog
privla~enja suprotno naelektrisanih ~estica. Zbog toga su elektri~ne
osobine koloidnih i drugih ~estica, ~ije se razdvajanje vr{i, ja~e
izra`ene u vodi, ~ija je elektri~na permitivnost ve}a od etanola i
drugih organskih rastvara~a. [to se ti~e prirode elektrolita oni mogu
obrazovati komplekse sa ~esticama koje se elektroforetski razdvaja-
ju. Na primer, gvo`|e(III)-jon u prisustvu hloridnih jona stvara, u
zavisnosti od pH, komplekse FeCl
2+
, FeCl
2
+
i FeCl
4
–
.
I vrsta podloge mo`e uticati na elektroforetsko kretanje ~estica.
Neke podloge poseduju na svojoj povr{ini funkcionalne grupe spo-
sobne da adsorbuju naelektrisane ~estice, ostvaruju}i sa njima fizi~-
ke ili hemijske veze. Pojava adsorpcije usporava kretanje ~estica i
izaziva {irenje zona, zbog ~ega mo`e do}i do njihovog preklapanja.
Na elektroforetsko kretanje ~estica uti~e i pojava
elektroosmoze
.
Posmatranjem rastvora pufera u katodnom i anodnom prostoru,
koji su premo{}eni podlogom natopljenom elektrolitom, mo`e se
zapaziti kretanje te~nosti prema katodi. Ova pojava obja{njava se
~injenicom da se te~nost u kontaktu sa povr{inom ~vrste podloge

Medenica / Male{ev
264
Aparatura i hemikalije
Ure|aj za izvo|enje elektroforeze (slika 1, str 261)
l
Filtar-hartija Watman M4
l
Acetatni pufer pH 4,6
l
Analizirana sme{a Fe(II)– i Fe(III)– jona
Postupak
Ise}i trake filtar-hartije Watman M4 {irine 1,5 cm i du`ine 30 cm. Na
rastojanju od 10 cm sa jedne strane trake obele`iti grafitnom olov-
kom liniju koja ozna~ava start. Nakvasiti traku destilovanom vodom
i polo`iti je na ~istu filtar-hartiju.
U sahatnom staklu pome{ati po 1 mL osnovnih rastvora Fe(II)– i
Fe(III)–jona i dodati 2 mL acetatnog pufera pH 2,5. Izme{ati rastvor
staklenim {tapi}em i kapilarom naneti ispitivanu sme{u u obliku {to
tanje crte du` startne linije.
U sve ~etiri pregrade kade za elektroforezu sipati acetatni pufer
pH 4,6. Postaviti traku na nosa~ tako da ne dodiruje dno kadice i da
bude dovoljno zategnuta. Krajevi trake, kao i grafitne elektrode, mo-
raju biti uronjeni u rastvor acetatnog pufera. Kada je sve postavljeno,
uklju~iti aparat i odgovaraju}im potenciometrom doterati napon
struje na 250 V. Elektroforetsko razdvajanje ove test-sme{e traje 2 sata.
Po zavr{etku razdvajanja isklju~iti aparat i izvaditi nosa~ sa trakama.
Ostaviti trake da se osu{e, a zatim provu}i kroz rastvor kalijum-hek-
sacijanoferata. Dobijaju se dve obojene trake koje treba identifiko-
vati i napisati reakcije identifikacije.
URADITE SAMOSTALNO...
Elektroforetsko
razdvajanje sme{e
F
e
(II)– i F
e
(III)– jona
Zadatak eksperimenta
n
Elektroforezom na papiru razdvojiti Fe(II)– i Fe(III)– jone
iz sme{e.
n
Prikazati dobijeni elektroforezogram i napisati reakcije
identifikacije.
Prilog
TABLICE
Gustine i koeficijenti viskoznosti za vodu na razli~itim temperaturama
Atomski i strukturni parahori
Gustine i koeficijenti povr{inskog napona za vodu na razli~itim temperaturama
Krioskopske konstante rastvara~a
Specifi~na toplota vode
Refrakcije atoma i veza na
λ
= 589 nm
Standardni potencijali elektroda
Specifi~na provodljivost 0,0100 mol L
–1
rastvora kalijum-hlorida
Molarna jonska provodljivost
λ
u vodi na 25°C
Molarne mase hemijskih elemenata
Simboli fizi~kih veli~ina
Simboli fizi~kih veli~ina koji se pi{u gr~kim slovima
Gr~ki alfabet
STATISTI^KA OBRADA REZULTATA

t°C
ρ
(kg m
-3
)
σ
(N m
-1
)
15
999,10
0,07348
16
998,94
0,07334
17
998,77
0,07320
18
998,60
0,07305
19
998,41
0,07289
20
998,20
0,07275
21
997,90
0,07260
22
997,77
0,07244
23
997,54
0,07228
24
997,30
0,07212
25
997,04
0,07196
26
996,78
0,07180
27
996,51
0,07164
28
996,23
0,07147
29
995,94
0,07131
30
995,65
0,07115
Rastvara~
K (K kg mol
–1
)
Kamfor
40,00
Ugljen-tetrahlorid
30,00
Fenol
7,27
Naftalen
6,94
Benzen
5,12
Sir}etna kiselina
3,90
Ugljen-disulfid
3,80
Voda
1,86
Medenica / Male{ev
268
Tablica 3.
Gustine i koeficijenti
povr{inskog napona za vodu
na razli~itim temperaturama
Tablica 4.
Krioskopske konstante
rastvara~a
t°C
c
v
(KJ kg
–1
K
–1
)
0
4,2177
10
4,1922
15
4,1858
20
4,1819
25
4,1796
30
4,1785
40
4,1786
50
4,1807
60
4,1844
70
4,1896
80
4,1964
90
4,2051
100
4,2160
Atom/veza
Refrakcija
[
R
]
D
C
2,418
H
1,100
O (karbonilni)
2,212
O (etarski)
1,643
O (hidroksilni)
1,525
N (prim. amin)
2,322
N (sec. amin)
2,499
N (terc. amin)
2,840
Cl
5,967
Br
8,865
J
13,900
–C=C–
1,733
–C
≡
C–
2,398
Eksperimentalna fizi~ka hemija
269
Tabela.5.
Specifi~na toplota vode
Tablica 6.
Refrakcije atoma i veza
(u CGS jedinicama)
na
λ
= 589 nm

Eksperimentalna fizi~ka hemija
271
Katjon
λ
(
Ω
–1
cm
2
mol
–1
)
Anjon
λ
(
Ω
–1
cm
2
mol
–1
)
Ba
2+
127,2
Br
–
78,1
Ca
2+
119,0
CH
3
COO
–
40,9
Cs
2+
77,2
Cl
–
76,3
Zn
2+
105,6
SO
4
2+
160,0
Cu
2+
107,2
ClO
4
–
67,3
K
+
73,5
F
–
55,4
Li
+
38,7
J
–
76,8
H
+
349,6
CO
3
2–
138,6
Mg
2+
106,0
NO
3
–
71,5
NH
4
+
73,5
OH
–
199,1
Tablica 9.
Molarna jonska provodljivost
λ
u vodi na 25°C
Medenica / Male{ev
272
Element
Simbol
kg mol
–1
Element
Simbol
kg mol
–1
Aluminijum
Al
0,02698
Kalijum
K
0,03910
Antimon
Sb
0,12175
Kiseonik
O
0,01600
Arsen
As
0,07492
Kobalt
Co
0,05893
Azot
N
0,01400
Magnezijum
Mg
0,02430
Bakar
Cu
0,06354
Mangan
Mn
0,05494
Bizmut
Bi
0,20898
Natrijum
Na
0,02299
Brom
Br
0,07990
Nikl
Ni
0,05871
Cink
Zn
0,06537
Olovo
Pb
0,20720
Fluor
F
0,01899
Paladijum
Pd
0,10640
Gvo`|e
Fe
0,05585
Platina
Pt
0,19509
Hlor
Cl
0,03545
Srebro
Ag
0,10787
Hrom
Cr
0,05199
Sumpor
S
0,03206
Jod
J
0,01269
Ugljenik
C
0,01201
Kadmijum
Cd
0,11240
Vodonik
H
0,00100
Kalcijum
Ca
0,04008
@iva
Hg
0,20059
Simbol
Fizi~ka veli~ina
SI jedinica
a
molarna apsorptivnost
m
2
mol
–1
a
aktivnost
1
A
povr{ina
m
2
A
apsorbancija
1
A
r
relativna atomska masa
1
b
debljina sloja, {irina
m
c
masena koncentracija
kg m
-3
c
molarna koncentracija
mol m
-3
Tablica 10.
Molarne mase hemijskih elemenata
Tablica 11.
Simboli fizi~kih veli~ina

K
koeficijent raspodele
1
K
A,B
koeficijent selektivnosti jon-selektivne elektrode
1
K
p
konstanta protolize
1
l
du`ina
m
m
masa
kg
m
molalna koncentracija
mol kg
–1
M
molarna masa
kg mol
–1
M
r
relativna molekularna masa
1
n
koli~ina supstancije
mol
n
indeks prelamanja
1
n
broj kapi
1
n
broj elektrona
1
N
indeks prelamanja staklene prizme
1
p
pritisak
Pa = N m
–2
P
proizvod rastvorljivosti
mol
2
dm
–6
Q
koli~ina elektriciteta
C
Q
koli~ina toplote
J
Q
molarna toplota rastvaranja
J mol
–1
r
radijus, polupre~nik
m
R
gasna konstanta
R = 8,314
J K
–1
mol
–1
R
elektri~ni otpor
Ω
R
1,2
molarna refrakcija sme{e
m
3
mol
–1
R
m
molarna refrakcija
m
3
mol
–1
R
f
konstanta podeone hromatografije
1
t
vreme
s
t
Celziusova temperatura
t°C = T – 273,15 K
T
termodinami~ka temperatura
K
u
jonska pokretljivost
m
2
s
–1
V
–1
U
napon
V
v
brzina
m s
–1
v
brzina reakcije
mol m
–3
s
–1
V
zapremina
m
3
V
gradijent brzine
s
–1
x
molski udeo supstancije
1
z
broj elektrona
1
z
koli~ina naelektrisanja
1
Medenica / Male{ev
274
S
IMBOL
F
IZI
~
KA VELI
~
INA
SI
JEDINICA
α
stepen protolize
1
α
podeoni (particioni) koeficijent
1
α
opti~ka rotacija
rad
[α]
specifi~na rotacija
rad m
2
kg
–1
[α]
M
molarna rotacija
rad m
2
mol
–1
γ
faktor aktivnosti
1
Γ
Gibzova povr{inska koncentracija
mol m
–2
η
koeficijent viskoznosti
Pa s
η
0
viskoznost rastvara~a
Pa s
η
sp
specifi~na viskoznost
1
η
red
redukovana viskoznost
dm
3
kg
–1
[η]
unutra{nja viskoznost
dm
3
kg
–1
ϕ
fluidnost
kg
–1
m s
κ
specifi~na provodljivost elektrolita
S m
–1
λ
talasna du`ina
m
λ
A
–
provodljivost anjona
S m
2
mol
–1
λ
K
+
provodljivost katjona
S m
2
mol
–1
Λ
molarna provodljivost elektrolita
S m
2
mol
–1
Λ
0
molarna provodljivost pri beskona~nom razbla`enju
S m
2
mol
–1
ρ
specifi~na otpornost
Ω
m
ρ
gustina
kg m
–3
σ
koeficijent povr{inskog napona
N m
–1
Σ
stehiometrijska suma
1
τ
vreme
s
Eksperimentalna fizi~ka hemija
275
Tablica 12.
Simboli fizi~kih veli~ina koji se pi{u gr~kim slovima

Razlika izme|u preciznosti i ta~nosti prikazana je na slici.
Preciznost
ukazuje na slaganje rezultata dva ili vi{e merenja spro-
vedena pod istim uslovima. Definisana je standardnom devijacijom
S
, varijansom ili parcijalnom disperzijom
S
2
, relativnom standard-
nom devijacijom
RSD
, koeficijentom varijacije
K
, standardnom de-
vijacijom srednje vrednosti
S
< x >
i amplitudom variranja
ω
. Preciz-
ni su oni rezultati koji su reproduktivni.
Standardna devijacija (S)
gde je:
(x
i
– < x >) – odstupanje i-tog merenja od srednje vrednosti < x >
(n – 1) – broj stepeni slobode
n – broj merenja.
Srednja vrednost < x > dobija se kao koli~nik sume svih rezultata
merenja i broja merenja:
Varijansa ili parcijalna disperzija (S
2
)
Eksperimentalna fizi~ka hemija
277
STATISTI^KA OBRADA REZULTATA
Podrazumeva niz matemati~kih postupaka kojima se tuma~e rezultati merenja
u pogledu njihove
preciznosti
i
ta~nosti
neta~no i neprecizno
ta~no i neprecizno
neta~no i precizno
ta~no i precizno
S =
Σ
n
i = 1
(x
i
– <x>)
2
n –
1
(1)
S
2
=
Σ
n
i = 1
(x
i
– <x>)
2
n –
1
(3)
<x> =
Σ
n
i = 1
x
i
n
(2)
Relativna standardna devijacija (RSD)
Koeficijent varijacije (K)
Standardna devijacija srednje vrednosti (S
< x >
)
Amplituda variranja
(
ω
) predstavlja razliku izme|u najve}e i
najmanje vrednosti merenja.
Ta~nost
ukazuje na ispravnost merenja. To je mera sigurnosti neke
metode. Smatra se da je ta~an onaj rezultat koji ne odstupa mnogo
od prave vrednosti. Definisana je apsolutnom gre{kom
A
i relativ-
nom gre{kom
R
.
Apsolutna gre{ka (A)
gde je:
x
i
– pojedina~na vrednost merenja
x – prava vrednost.
Mo`e imati (+) i (–) predznak, za razliku od matemati~ke apso-
lutne vrednosti.
Kako se apsolutna vrednost ne mo`e odrediti, apsolutna gre{ka
se izra~unava iz srednje vrednosti i tada se naziva
prividna gre{ka
ili
apsolutna gre{ka pojedina~nog merenja
:
278
RSD =
.
1000
‰
S
x
(4)
K =
.
100
%
S
<x>
(5)
S
<x>
=
A = x
i
– x
S
√
n
(6)
(7)
∆
x = x
i
– <x>
(8)

B
ROJ MERENJA
POUZDANOST
n
90%
95%
99%
3
0,941
0,970
0,994
4
0,765
0,829
0,926
5
0,642
0,710
0,821
6
0,560
0,625
0,740
7
0,507
0,568
0,680
8
0,468
0,526
0,634
9
0,437
0,493
0,598
10
0,412
0,466
0,568
Medenica / Male{ev
280
Tablica 1.
Kriti~ne vrednosti koli~nika Q
Studentova t raspodela
Za definisanje
granice intervala pouzdanosti
neke metode ko-
risti se
Studentov t test
, koji omogu}ava odre|ivanje verovatnog in-
tervala u kome se nalazi pravi rezultat:
gde je
E
– ta~nost odre|ivanja, a izra~unava se kao proizvod faktora
Studentove raspodele
t
i standardne devijacije srednje vrednosti
S
< x >
:
Vrednosti faktora Studentove raspodele t, prema broju stepeni
slobode K i pouzdanosti, nalaze se u tablici 2.
<x> ± E
(12)
E = t × S
<x>
(13)
Tablica 2.
Faktori Studentove raspodele
Stepen slobode
Pouzdanost
K = (n – 1)
80%
90%
95%
99%
99,9%
1
3,08
6,31
12,7
63,7
637
2
1,89
2,92
4,30
9,92
31,6
3
1,64
2,35
3,18
5,84
12,9
4
1,53
2,13
2,78
4,60
8,60
5
1,48
2,02
2,57
4,03
6,86
6
1,44
1,94
2,45
3,71
5,96
7
1,42
1,90
2,36
3,50
5,40
8
1,40
1,86
2,31
3,36
5,04
9
1,38
1,83
2,26
3,25
4,78
10
1,37
1,81
2,23
3,17
4,59
11
1,36
1,80
2,20
3,11
4,44
12
1,36
1,78
2,18
3,06
4,32
13
1,35
1,77
2,16
3,01
4,22
14
1,34
1,76
2,14
2,98
4,14
Eksperimentalna fizi~ka hemija
281
Primer
Izvr{eno je deset merenja indeksa refrakcije i rezultati su pore|ani
po rastu}em nizu:
x
1
= 1,4815
x
2
= 1,4830
x
3
= 1,4830
x
4
= 1,4831
x
5
= 1,4832
x
6
= 1,4832
x
7
= 1,4832
x
8
= 1,4833
x
9
= 1,4834
x
10
= 1,4840

Kona~no, verovatni interval u kome se nalazi pravi rezultat, pre-
ma izrazu (12), iznosi:
< x > ± E = 1,4833 ± 3 ×10
–4
Metoda najmanjih kvadrata
Kalibraciona kriva je, u podru~ju npr. linearne zavisnosti apsorban-
cije od koncentracije rastvora, definisana jedna~inom prave:
y = ax + b
gde je:
a – nagib prave
b – odse~ak na ordinati.
Da bi se ocenila ispravnost eksperimentalno dobijene kalibra-
cione krive, potrebno je konstruisati ovu krivu metodom najmanjih
kvadrata, tzv.
teorijsku krivu
. Za dobijenu pravu parametri
a
i
b
izra~unavaju se iz slede}ih izraza:
gde je:
x
i
– koncentracija i-tog rastvora
< x > – srednja vrednost koncentracije
y
i
– apsorbancija i-tog rastvora
< y > – srednja vrednost apsorbancije
n – broj merenja.
Eksperimentalna fizi~ka hemija
283
a =
Σ
Σ
x
i
y
i
– n <x> . <y>
x
i
2
– n <x>
2
(14)
b =
<y> – a<x>
(15)
Za izra~unavanje parametara teorijske krive potrebno je
izra~unati vrednosti date u tabeli 1.
Simbol
Vrednost
Simbol
Vrednost
Σ
x
i
Σ
y
i
< x >
< y >
< x >
2
Σ
x
i
y
i
Σ
x
i
2
a
n
b
Na osnovu izra~unatih vrednosti parametara
a
i
b
izra~unati teorij-
ske vrednosti apsorbancija (y) za rastvore poznatih koncentracija
(x). Prikazati tabelarno (tabela 2) i na osnovu tabele teorijsku krivu
prikazati grafi~kim putem, a vrednosti dobijene eksperimentalnim
putem uneti samo kao ta~ke. Tako se mo`e videti odstupanje teorij-
skih od eksperimentalnih vrednosti.
Teorijska kriva
a = .........
b = .........
Medenica / Male{ev
284
Tabela 1.
Metoda najmanjih kvadrata
Tabela 2.
x
y

1. Atkins P.,
Physical Chemistry
,
W. H. Freeman and Company,
New York 1990.
2. Atkins P., Clugston M.,
Na~ela fizikalne kemije
,
[kolska knjiga, Zagreb 1989.
3. Cvita{ T., Kallay N.,
Fizi~ke veli~ine i jedinice
me|unarodnog sustava
,
Hrvatsko hemijsko dru{tvo, Zagreb
1975.
4. akovi} Lj.,
Koloidna hemija
,
Tehnolo{ki fakultet, Zavod za izdavanje
ud`benika, Novi Sad 1990.
5. or|evi} S. i saradnici,
Hemijsko tehnolo{ki priru~nik,
Fizi~kohemijske metode
,
Rad, Beograd 1985.
6. or|evi} S., Dra`i} V.,
Fizi~ka hemija
,
Tehnolo{ko-metalur{ki fakultet,
Beograd 1990.
7. Egert J., Hok I., [vab G.,
Ud`benik fizi~ke hemije
,
Nau~na knjiga, Beograd 1966.
8. Ewing G.,
Instrumental Methods of Chemical
Analysis
,
McGraw-Hill Kogakusha, Ltd., 1975.
9. Filipovi} I., Sabion~elo P.,
Laboratorijski priru~nik
,
Tehni~ka knjiga, Zagreb 1970.
10. Florence A., Attwood D.,
Physicochemical Principles of Pharmacy
,
The MacMillan Press Ltd., London
1988.
11. Foti} Lj.,
Instrumentalne metode hemijske
analize
,
Tehnolo{ko-metalur{ki fakultet,
Beograd 1981.
12. Gleston S.,
Ud`benik fizi~ke hemije
,
Nau~na knjiga, Beograd 1967.
13. Glasstone S.,
An Introduction to Electrochemistry
,
D. Van Nostrand Company, inc.,
New York 1954.
14.
Handbook of Chemistry and Physics
,
forty-third edition,
The Chemical Rubber Publishing Co.,
Cleveland, Ohio 1962.
15. Harrison G., Lord R., Loofbourow J.,
Prakti~na spektroskopija
,
Nau~na knjiga, Beograd 1962.
16. Ivanovi} D., Vu~i} V.,
Fizika II
Nau~na knjiga, Beograd 1980.
17. Janji} T.,
Teorijski osnovi analiti~ke hemije
,
Nau~na knjiga, Beograd 1971.
18. Jovanovi} M.,
Elektroanaliti~ka hemija
,
Tehnolo{ko-metalur{ki fakultet,
Beograd 1978.
19. Macinnes D.,
The Principles of Electrochemistry
,
Dover Publications, inc., New York
1961.
20. Martin A., Swarbrick J.,
Cammarata A.,
Physical Pharmacy
,
Lea & Febiger, Philadelphia 1969.
21. Medenica M., Male{ev D.,
Eksperimentalna fizi~ka hemija
i instrumentalne metode
,
dr Mirjana Medenica, Beograd 1994.
22. Mi{ovi} J., Ast T.,
Instrumentalne metode hemijske
analize
,
Tehnolo{ko-metalur{ki fakultet,
Beograd 1989.
23. Nikoli} D., Vela{evi} K., Nikoli} K.,
Praktikum instrumentalne analize
,
Medicinska knjiga, Beograd-Zagreb
1989.
24. Obradovi} M., i saradnici
Hemijsko tehnolo{ki priru~nik, Hemijski
i fizi~ki podaci i veli~ine
,
Rad, Beograd 1987.
25. Purdy W.,
Methods in Biochemistry
,
McGraw-Hill Book Company, New
York 1965.
26. Rajkovi} M., Vu~urovi} B.,
Koeficijent selektivnosti jon-selektivne
elektrode
,
Arhiv za farmaciju, Beograd, 4-5
(1992) 141.
27. Rendle P., Vokins M., Davis P.,
Experimental Chemistry
,
Edward Arnold Ltd., London 1972.
28. Saunders L.,
Principles of Physical Chemistry
for Biology and Pharmacy
,
Oxford University Press, London 1971.
29. Skoog A. D.,
Principles of Instrumental Analysis
,
Saunders College Publishing,
New York 1985.
30. Skoog A. D., West M. D., Holler J. F.,
Fundamentals of Analytical Chemistry
,
Saunders College Publishing, Fort
Worth 1992.
Eksperimentalna fizi~ka hemija
287
31. Todorovi} M., ur|evi} P.,
Antonijevi} V.,
Opti~ke metode instrumentalne analize
,
Hemijski fakultet Unuverziteta u
Beogradu, Beograd 1997.
32. [u{i} M.,
Elektrohemija
,
Nau~na knjiga, Beograd 1970.
33. Vela{evi}-@ivkovi} K., Nikoli} K.,
Osnovi spektroskopskih metoda
,
Zavod za ud`benike i nastavna
sredstva, Beograd 1986.
34. Veselinovi} S. D.,
Jon-selektivne elektrode
,
Glasnik Hemijskog dru{tva, Beograd,
43 (1978) 817.
35. Vra~ar Lj. i saradnici,
Eksperimentalna fizi~ka hemija
,
Tehnolo{ko-metalur{ki fakultet,
Beograd 1990.
Medenica / Male{ev
288

A
aditivne osobine
50
adsorbat
227
adsorbens
227, 240, 247
adsorpcija
227
adsorpciona izoterma
Frojndlihova 229
Gibzova 228
alkalna gre{ka
144
Ami}ijeve prizme
53, 54
analizator
63, 67
apsorbancija
77, 78, 88
apsorpcija
75
apsorpciona mo}
76
apsorpcioni koeficijent
78, 85
apsorpcioni spektar
87, 94, 101
apsorptivnost
77
B
Bekmanov termometar
32, 39
Berov zakon
77
bimolekulska reakcija
218
boja 75
C
cevni potenciometar
146
D
Denijelov spreg
125
Diboskov kolorimetar
79, 81
difrakciona re{etka
96
disperzija
molarna 51
rotaciona 65
specifi~na 51
Djuarov sud
40
dodirni napon
16
dvostruki elektri~ni sloj
126
E
egzoterman proces
39
ekscitacija
93
elektroda
`ivina 133
bakarna 126
cinkana 126
druge vrste 128
fluoridna 152
hinhidronska 137
indikatorska 127
jodna 152
jon-selektivna 151
kadmijumova 133
kalomelova 128
kombinovana 145
merkuro-sulfatna 169
platinska 140, 181
prve vrste 127
pX 151
referentna 127
srebrova 169, 175
srebro-sulfidna 169
staklena 137, 163
standardna vodoni~na 130
vodoni~na 127, 130
zlatna 181
elektroforeza
259
niskonaponska 260
slobodna 260
visokonaponska 260
zonska 260
elektrohemijski ekvivalent
110
elektroliti~ki most
125
elektroliza
109
elektromagnetsko zra~enje
93
elektromotorna sila
125, 131
elektronski gas
126
elektroosmoza
262
eluat
240
eluent
240, 241
eluiranje
240
endoterman proces
39
F
faktor aktivnosti
127
faktor korekcije
207
faradej
109
Faradejev zakon
109
fluiditet
4
foto}elija
87
gasna 97
selenska 97
vakuumska 97, 98
fotocev
97
fotodetektor
96, 97
fotoelektri~ni kolorimetar
86
fotoelement
97
fotometar
75, 86, 89
fotometrija
85
fotomultiplikator
98
fotostruja
97
frontalna analiza
240
G
galvanska }elija
125
grani~ni ugao
52, 54
grani~ni viskozitetni broj
5
H
hemisorpcija
229
Heplerov viskozimetar
11
hidroliza saharoze
221, 223
hiralni centar
64
hromatografija
239
adsorpciona 240, 253
dvodimenzionalna 245
horizontalna 244, 246
jonoizmenjiva~ka 239, 249, 255
kru`na 244
particiona 239, 242
podeona 239, 242, 254
silazna 244, 246
uzlazna 244, 246
hromatogram
241, 247
hromofore
93
I
indeks prelamanja
apsolutni 49
relativni 49
istiskivanje
240
J
jonska ja~ina
156
K
kalibracija
kolorimetra 82
pH-metra 148
pH-metra u dve ta~ke 148
pH-metra u jednoj ta~ki 148
stalagmometra 21
viskozimetra 12
kalibraciona kriva
79, 95, 101
kalorimetar
39
adijabatski 40
sa vodom 40
Eksperimentalna fizi~ka hemija
291
Medenica / Male{ev
292
kalorimetrija
39
kapacitet smole
250, 256
kapilarna elevacija
19
kisela gre{ka
144
kiveta
99, 104
koeficijent
apsorpcioni 78, 85
molarni apsorpcioni 78
podeoni 242
povr{inskog napona 15
pravca 154, 157
raspodele 239
selektivnosti jon-selektivne
elektrode 151
viskoznosti 9
koligativne osobine
30
kolimatorsko so~ivo
86, 95, 99
kolorimetar
75
kolorimetrija 75
Kolrau{ov zakon
194
komplementarna boja
87, 89
konduktometar
209
konduktometrija
189
konduktometrijska }elija
197
konstanta
brzine hemijske reakcije 218
ebulioskopska 29
kapilarna 15
konduktometrijske }elije 190
krioskopska 29
Kunove jedna~ine 6
protolize 159, 195
stabilnosti kompleksa 159
konstitutivne osobine
50
krioskopija
27
kulometar
111, 112
bakrov 111
gasni 112
jodni 112
srebrov 112
kulometrija
pri konstantnoj ja~ini struje 115
pri konstantnom potencijalu 115
kulometrijska titracija
115
neposredna 116
posredna 116
kulon
109
Kun-Mark-Hauvinkova jedna~ina
6
L
Lamber-Berov zakon
78, 85, 94
Lamberov zakon
76
lampa
deuterijumova 96
kvarc-jodna 96
natrijumova 67, 69
vodoni~na 96
volframova 80, 86, 104
Laplasova jedna~ina
19
Lorenc-Lorencova jedna~ina
50
lutaju}i elektroni
105
M
me|ufazni napon
16
me|upovr{inski napon
16, 20
molarna rotacija
66
molarni apsorpcioni koeficijent
78
monohromator
86, 96, 104
monomolekulska reakcija
218
mutarotacija
66
N
neredovan zrak
62
Nernstova jedna~ina
126
Nikolova prizma
62
NJ
Njutnov zakon 3
O
Omov zakon
189
opacitet
78
opti~ka aktivnost
64
opti~ka prizma
96
opti~ka rotacija
64
oscilacije
elektri~ne 61, 62
magnetne 61, 62
Ostvaldov viskozimetar
9
P
parahor
16, 50
paskal
4
pH 137
pH
-metar
143, 146
Poazejev zakon
8
Pogendorfova metoda
131, 175
polarimetar
66, 69, 223
polarimetrija
61, 66, 68
polarizacija
62
polarizator
63, 67
polarizovana svetlost
62, 65
polaroid
62
polihromatska svetlost
86
polimolekulska reakcija
219
potencijal
asimetrije 143
elektrode 126
membranski 143
ravnote`ni 126
standardni 126
potenciometrija
125
potenciometrijska kriva
integralna 160
prvog izvoda 160
drugog izvoda 160
povr{inski napon
15, 231
koeficijent 18
odre|ivanje 17
prehla|enje
34
proizvod rastvorljivosti
129
provodljivost
189
molarna 192
molarna jonska 193
pri beskona~nom razbla`enju 193
specifi~na 189
pseudo-prvog reda reakcija
220
R
Raulov zakon
27
razrez (slit)
99, 104
red reakcije
217, 220
redovan zrak
62
R
f
vrednost
243
refleksiona mo}
76
refrakcija
atoma 50
molarna 50
sme{e 51
specifi~na 50
veze 50
refraktometar
52
Abeov 52, 53, 55, 56
imerzioni 52
Pulfrihov 52
refraktometrija
49
regenerisanje smole
251
reohor
6
reologija
3

544(075.8)
543.08(075.8)
MEDENICA, Mirjana
Eksperimentalna fizi~ka hemija / Mirjana
Medenica, Du{an Male{ev ;
[
fotografije
Branislav Nikoli}
] . − [
2. izd.
] . −
Beograd :
M. Medenica, 2002 (Beograd : Akademija) . -
293 str. : ilustr. ; 24 cm
Tira` 1500. - Bibliografija: str.
287-288. - Registar.
ISBN 86-901485-4-X
1.
Male{ev, Du{an
a)
Fizi~ka hemija - Instrumentalni metodi
COBISS-ID 101594124
CIP -
Katalogizacija u publikaciji
Narodna biblioteka Srbije, Beograd
Želiš da pročitaš svih 1 strana?
Prijavi se i preuzmi ceo dokument.
Slični dokumenti

Ovaj materijal je namenjen za učenje i pripremu, ne za predaju.


























































