
Zagadjenje vazduha vestačkim djubrivima Pregled
UNIVERZITET U BEOGRADU
Tehnički fakultet u Boru
SEMINARSKI RAD
IZ PREDMETA:
ZAGAĐENJE I ZAŠTITA VAZDUHA
TEMA:
PROIZVODNJA VEŠTAČKIH ĐUBRIVA I
ZAGAĐENJE VAZDUHA
PROFESOR:
STUDENT:
dr Snežana Šerbula
Nataša Kračunović 169/09
Bor, septembar,2013.
Sadržaj
.................................................................................................12
5.1. Zagađivanje veštačkim đubrivima u Kini
.................................................................16
.................................................................................................19
1

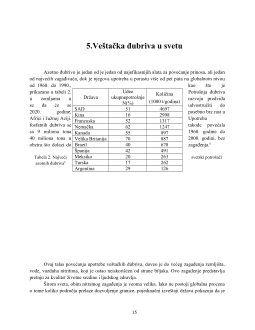
Tabela 1. Sadržaj elemenata u veštačkom đubrivu
3
Glavni razlog zašto veštčka đubriva postaju zagađujuće materije u životnoj sredini je
njihova neadekvatna i preterana upotreba. Prekomerna upotreba đubriva može biti jednako štetna
kao i premala količina.
U toku proizvodnje veštačkih đubriva nastaju dve grupe zagađivača. U prvu spadaju oni,
koji se neposredno proizvode samim radnim procesom i mogu se smatrati opštim zagađivačima.
Drugu grupu predstavljaju supstance koje se sintetizuju ili direktno dobijaju tehnološkim
operacijama, a po svom sastavu su toksične za okolinu.
2
Azotna đubriva koja sadrže nitrate mogu zagaditi vazduh, kao i fosforna đubriva. Sa
visokim koncentracijama u vazduhu i vodi, nitrati mogu otrovati ljude, posebno decu. Đubrivo
koje usev ne iskoristi dospeva u životnu sredinu kroz zemljište u podzemne i površinske vode, pa
u vazduh, gde izaziva najveće štete.
1
3
2. Proizvodnja veštačkih đubriva
Đubriva su uglavnom u čvrstom stanju, u obliku granula dobijenih postupkom
granuliranja koji se primenjuje u proizvodnji većine veštačkih đubriva. Danas se, međutim,
proizvode i tečna đubriva, većinom azotna, koja imaju niz prednosti u primeni.
4
Veštačka đubriva se trenutno proizvode na način koji je nemoguće koristiti beskonačno.
Kalijum i fosfor dolaze iz rudnika (ili slanih voda, kao što je Mrtvo more) i takvi izvori su
ograničeni. Atmosferski nevezani azot je efektivno neograničen izvor (više od 70% sastava
atmosfere čini azot), ali je u takvom obliku neupotrebljiv za biljke. Da bi taj azot postao koristan
biljkama, potrebna je fiksacija (prevođenje atmosferskog azota u oblik koji biljke mogu koristiti).
Veštačka azotna đubriva se tipično sintetizuju koristeći fosilna goriva kao što je prirodni gas i
ugalj, koji predstavljaju ograničene izvore.
4
2.1. KAN (NH
4
NO
3
)
Azot se u NH
4
NO
3
(KAN) nalazi u amonijačnom i nitratnom obliku. KAN ima nepovoljna
fizička svojstva, veoma je higroskopan, pa stajanjem na vazduhu otvrdnjava, zbog toga se na
kraju procesa proizvodnje dodaje kreč ili gips. Osnovne sirovine za proizvodnju KAN-a su
amonijak, 56% azotna kiselina i krečnjak. Kao pogonska energija koristi se vodena para i
električna energija.
4
Faze u procesu proizvodnje su:
1. Neutralizacija,
2.Koncentrovanje rastvora NH
4
NO
3
,
3. Mešanje NH
4
NO
3
sa krečnjakom,
4. Granulisanje KAN-a,
5. Sušenje i hlađenje granula,
6. Zaprašivanje granula.
Neutralizacija
Proces proizvodnje veštačkih đubriva svodi se na procesu neutralizacije kiseline i baze uz
znatnih količina toplote. Za razliku od kiselina i baza ovi procesi nisu katalizovani. Proces
neutralizacije se vrši u neutralizatoru koji je cilindričnog oblika, izrađen od nerđajućeg čelika.
Dva skladištena rezervoara za azotnu kiselinu, prihvataju 56 % azotnu kiselinu iz pogona,
temperature oko 35-40°C. Centrifugalne pumpe dižu pritisak kiseline na 4,5-5 bar-a. Određena
količina pregrejane amonijačne pare se uvodi u neutralizator kroz specijalne raspršivače za
amonijak. Preko centrifugalnih pumpi dodaju se kiseline koliko je potrebno da bude blizu
stehiometrijskom odnosu potrebnom za neutralizaciju. U neutralizatoru je temperature 180 I C, a
4
Slika 1.Procesna šema proizvodnje KAN-a, vlažna sekcija
4
2.2. Karbamid (UREA)
Karbamid spada u visoko koncentrovana azotna đubriva. Po fizičkim osobinama
pogodniji je od amonijum nitrata, nije higroskopan i ne zgrudvava se. Dobijeni karbamid je bio u
obliku veoma razblaženih rastvora za čije je koncentrisanje bilo potrebno dosta toplote pa je zato
ovaj postupak vremenom napušten.
Danas se urea proizvodi najviše sintezom iz ugljen-monoksida i amonijaka.
Osnovne reakcije sinteze se mogu predstaviti jednačinama :
2NH
3
+ CO
2
↔ NH
2
∙COONH
4
, ∆H
◦
298
= - 161,61 kJ/mol
(2)
NH
2
COONH
4
↔ NH
2
CONH
2
+ H
2
O , ∆H
◦
298
= 28,47 kJ/mol
(3)
2NH
3
+ CO
2
↔ NH
2
CONH
2
+ H
2
O, ∆H
◦
298
= -133,14 kJ/mol
(4)
Celokupan proces je egzoterman ali zahteva povišene temperature za drugi stupanj
reakcije i pritisak, što je iz gornjih jednačina očigledno. Da bi se dobile granule karbimida, u
6
Želiš da pročitaš svih 23 strana?
Prijavi se i preuzmi ceo dokument.
Slični dokumenti

Ovaj materijal je namenjen za učenje i pripremu, ne za predaju.


























































