
Enzimi-fermenti Pregled
VISOKO POLJOPRIVREDNO-PREHRAMBENA ŠKOLA
STRUKOVNIH STUDIJA U PROKUPLJU
ENZIMI (FERMENTI)
SEMINARKI RAD
Mentor: dr. Violeta Rakić Strudent:
Igor Đorđević
PT736/16
Prokuplje, decembar 2017.
SADRZAJ:
1.Uvod....................................................................................................... 3
2. Teorijski deo..........................................................................................4-5
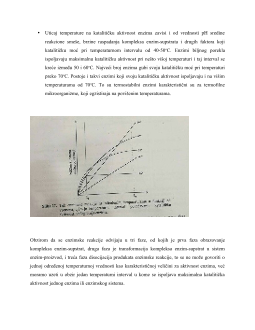
3.Uticaj temperature na brzinu enzimske aktivnosti……………………..6,7
4.Uticaj pH sredine na aktivnost enzima……………… ……………...8-9-10
5. Literatura………………………………………………………………11
2.TEORIJSKI DEO
Po svojoj hemijskoj prirodi enzimi su složena jedinjenja proteinskog karaktera. Proteinska
priroda enzima potvrđena je time što je dokazano da se ugljenik, vodonik, kiseonik, azot i
sumpor nalaze u istom odnosu kao i u proteinima. Pored toga, enzimi u svojoj strukturi sadrže i
pojedin ejonove kao što su: Mg
2+
, Zn
2+
, Fe
2+
, Cu
2+
,Mn
2+ ,
a pojedini enzimi u svojoj strukturi
sadrže i manje količine fosfora u različitim oblicima. Pored sličnosti u elementarnom sastavu, i
hemijska struktura jednog dela enzima slična je strukturi proteina. Naime, veliki broj
aminokiselina koje ulaze u sastav proteina nalaze se u strukturi enzima. Ne samo sličnost u
elementarnom i aminokiselinskom sastavu enzima sa proteinima, već i neke druge značajne
karakteristike potvrđuju da su enzimi proteinske prirode. Jedan od očiglednih dokaza je i način
kretanja enzima u električnom polju, koje je vrlo sličan ili čak identičan kretanju rastvora
proteina. U osnovi ove sličnosti je osobina amfoternosti, enzima i proteina. Pored toga, različiti
fizički i hemijski agensi koji vrše denaturaciju proteina, utiču i na umanjenje ili pak totalno
gubljenje katalitičke moći enzima, što ustvari predstavlja denaturaciju proteinskog dela enzima.
Tako na primer, promenom pH vrednosti sredine, delovanjem mineralnih i organskih kiselina,
visokom temepraturom, možemo izazvati potpuno gubljenje katalitičke aktivnosti enzima. Treba
napomenuti da je aktivnost jednog enzima vezana za strukturu pojedinih delova makromolekula
proteina koji ulazi u sastav enzima, tako da ostali deo strukture proteinskog dela ne utiče na
ispoljavanje katalitičke moći enzima. Veći broj enzima po svom hemijskom sastavu predstavlja
konjugovane proteine. U ovim enzimima za proteinski deo, vezan je neproteinski deo, koji u
svojoj strukturi ne sadrži aminokiseline, tj. Nema proteinski karakter. Obzirom na značaj
neproteinskog dela enzima, možemo slobodno reći da katalitička aktivnost enzima podjednako
zavisi i od proteinskog i od neproteinskog dela. Postoje različiti primeri prirode neproteinskog
dela enzima. Tako na primer, oksido-redukcioni enzimi imaju takvu građu gde je neproteinski
deo gvožđe-profirin, ili pak, grupa enzima koje nazivamo anaerobne-dehidrogenaze, gde se
ubijaju i flavinske dehidrogenaze koje su karakteristične po tome što njihov neproteinski deo čini
fosfat-riboflavina. Neproteinski deo enzima naziva se koenzim ili koferment. Proteinski deo
enzima naziva se apoenzim ili apoferment, a enzim u celosti naziva se holoenzim ili holoferment.
Želiš da pročitaš svih 12 strana?
Prijavi se i preuzmi ceo dokument.
Slični dokumenti

Ovaj materijal je namenjen za učenje i pripremu, ne za predaju.


























































