
Koenzimi i vitamini: uloga u enzimskim reakcijama
1
Enzimi su, po definiciji, proteini.
Međutim, kod mnogih enzima (naročito oksidoreduktaza i
transferaza) peptidna komponenta nije dovoljna za ispoljavanje
katalitičke aktivnosti, nego se u aktivnom
centru nalazi i neka nepeptidna komponenta
– kofaktor – koja aktivnom centru obezbeđuje dodatne
funkcionalne grupe (npr. redoks-aktivne ili elektrofilne). Kovalentnim ili nekovalentnim vezivanjem kofaktora
za neaktivni peptidni deo (apoenzim) nastaje aktivna forma
– holoenzim. Neki kompleksni enzimi čak
zahtevaju nekoliko kofaktora (npr. kompleks piruvat dehidrogenaze koristi TPP, lipoamid, FAD, NAD, CoA i
Mg
2+
).
Kofaktori se mogu podeliti na dve velike grupe
– organske i neorganske. U neorganske
kofaktore spadaju
različiti metalni joni (Fe, Mn, Co, Zn, Mo...), koji mogu biti vezani čvrsto (kod
metaloenzima) ili labilno (ako samo
služe kao aktivatori), kao i gvožđe-sumpor klasteri. Mnogi od minerala
neophodni su organizmu upravo zbog izgradnje
određenih enzima. Primeri enzima koji u aktivnom centru
sadrže metalne jone su citohrom oksidaza (Cu), katalaza, citohromi, kompleksi I-IV (Fe), DNK polimeraza,
glukoza 6-fosfataza, heksokinaza (Mg), ureaza (Ni), glutation peroksidaza (Se), DNK polimeraza,
karboanhidraza, alkohol dehidrogenaza (Zn) itd.
Organski kofaktori se, prema
načinu vezivanja za apoenzim, grubo mogu podeliti na
labilno vezane (koenzime) i
čvrsto vezane (prostetske grupe), mada u literaturi ponekad postoje odstupanja
od ovih definicija (u okviru ovog kursa, pod koenzimima
će se podrazumevati sva neproteinska organska
jedinjenja neophodna za enzimsku aktivnost). Prvu grupu
čine organski molekuli koji su vezani za enzim
samo u toku reakcije. Pri reakciji oni se hemijski menjaju
(ponašaju se kao kosupstrati u reakciji), te se
nakon reakcije moraju odvojiti sa enzima i regenerisati (upravo se po stalnom recikliranju razlikuju od
običnih supstrata, koji tipično podležu daljim reakcijama). Prostetske grupe su za aktivni centar vezane
kovalentno (ili velikim brojem nekovalentnih interakcija), ostaju vezane za apoenzim, i u okviru svakog
katalitičkog ciklusa se regenerišu.
Koenzimi su
često vitamini ili se sintetišu iz vitaminâ, uglavnom hidrosolubilnih vitamina B-
kompleksa. Dok mnogi organizmi mogu da ih
sintetišu
de novo*
,
životinje ih najčešće moraju uneti hranom;
deficijencija dovodi do razvoja niza obol
јenja (uključujući skorbut, beriberi, pelagru, neke vidove dermatitisa i
anemije).
*biosinteza
de novo
= iz jednostavnih prekursora
2
U tabeli su navedeni neki od
najvažnijih koenzima, sa najbitnijim metaboličkim funkcijama.
4
NAD
+
i NADP
+
omogućavaju transfer elektronâ sa supstratâ (tj. predstavljaju elektron-
akceptore). Koenzimi su dehidrogenaza
– grupe oksidoreduktaza koje oksiduju alkohole, aldehide,
hidroksikiseline, aminokiseline i sl. uz uklanjanje 2 atoma H iz supstrata. Primeri NAD-zavisnih enzima su
neki od enzima metabolizma ugljenih hidrata: alkohol dehidrogenaza (R-CH
2
OH + NAD
+
R-CHO + NADH
+ H
+
; ova reakcija
značajna je kod alkoholnog vrenja i kod metabolisanja alkohola), laktat dehidrogenaza
(laktat + NAD
+
piruvat + NADH
+
+ H
+
; ova reakcija
značajna je kod mlečnokiselinskog vrenja i mišićne
aktivnosti u
slučaju hipoksije), gliceraldehid-3-fosfat dehidrogenaza (G3P + NAD
+
+ Pi
1,3BPG + NADH +
H
+
; reakcija je deo glikolize).
Aktivni deo molekula je piridinski prsten (u sklopu nikotinamida), koji od supstrata
može da
primi dva elektrona u vidu hidridnog anjona (H
–
) koji se
veže u poziciji C-4 prstena*. Pritom NAD
+
prelazi u
NADH, a NADP
+
u NADPH. Elektron-akceptorska svojstva
potiču od elektronskog deficita u C-4 poziciji
prstena (a koji
potiče od delokalizacije šarže). Nastali NADH i NADPH dovoljno su stabilni da se mogu
prenositi kroz
ćeliju (za razliku od flavinskih koenzima), i služiti kao izvor elektrona u različitim biohemijskim
reakcijama
(pretežno u biosintezama).
NAD(P)
+
se
ponaša kao kosupstrat – troši se tokom reakcije i mora se regenerisati
posebnim enzimatskim reakcijama (u putevima biosinteze, ili u elektron-transportnom nizu). Reoksidacija
NAD(P)H u elektron-transportnom nizu ima
ključnu ulogu u energetskom metabolizmu. Naime, energija koja
se
oslobađa prilikom oksidacije metaboličkih goriva iz hrane prvenstveno se skladišti u formi NADH. NADH
dalje
uskladištenu energiju (elektrone) predaje elektron-transportnom nizu u mitohondrijama, koji je koristi za
sintezu ATP.
* Naravno, hidridni anjon ne postoji kao takav u
biološkim sistemima, nego se prosto prenosi H-atom koji je
bio vezan u sklopu nekog molekula, pri
čemu se prenose i oba elektrona iz veze.
5
Flavinski nukleotidi
sintetišu se iz vitamina B
2
(riboflavina) kao prekursora. Riboflavin
sintetišu zelene biljke (naročito je zastupljen u zelenom lisnatom povrću, integralnim žitaricama i
mahunarkama), bakterije
(uključujući i intestinalne) i gljive, a životinje ne (mada je prisutan i u hrani
životinjskog porekla – mesu, iznutricama, jajima, mleku). Dok su žitarice relativno siromašne (naročito
ukoliko su
spoljašnji slojevi semena uklonjeni), zbog konzumiranja velikih količina u mnogim delovima sveta
značajno doprinose unosu vitamina B
2
. Nekim namirnicama (hrana za bebe, cerealije, testenine, sosovi,
tvrdi sirevi, napici) se riboflavin ili FMN dodaju kao boja* (E101) i/ili vitaminski suplement.
Deficit riboflavina (koji je na zapadu redak) manifestuje se tamnocrvenim jezikom,
seboreičnim dermatitisom, oštećenjima sluzokože, usporenim rastom. U (retkim) ozbiljnijim slučajevima
dolazi do prestanka rasta, slabosti, ataksije, kome i smrti. Do hipervitaminoze ne dolazi zbog niske
rastvorljivosti i apsorpcije, i lakog
izlučivanja.
Riboflavin
sadrži šećerni alkohol ribitol (koji se izvodi od riboze) koji je preko N-10 vezan
za
heterociklično jedinjenje izoaloksazin, i može se smatrati nukleozidom. Aktivna forma koenzima su flavin-
mononukleotid (FMN) i flavin-adenin-dinukleotid (FAD). FMN nastaje 5
’-fosforilacijom ribitola u riboflavinu, a
FAD
– formiranjem fosfoanhidridne veze između FMN i AMP.
* žuta boja Cedevite potiče od riboflavina

7
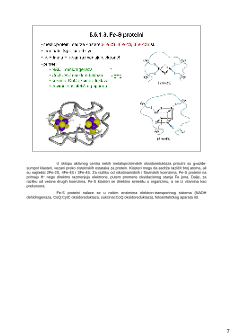
U sklopu aktivnog centra nekih metaloproteinskih oksidoreduktaza prisutni su
gvožđe-
sumpor klasteri, vezani preko cisteinskih ostataka za protein. Klasteri mogu da
sadrže različit broj atoma, ali
su
najčešći 2Fe-2S, 4Fe-4S i 3Fe-4S. Za razliku od nikotinamidnih i flavinskih koenzima, Fe-S proteini na
primaju H
–
nego direktno razmenjuju elektrone, putem promene oksidacionog stanja Fe jona. Dalje, za
razliku od
većine drugih koenzima, Fe-S klasteri se direktno sintetišu u organizmu, a ne iz vitamina kao
prekursora.
Fe-S proteini nalaze se u nekim enzimima elektron-transportnog sistema (NADH
dehidrogenaza, CoQ:CytC oksidoreduktaza, sukcinat:CoQ oksidoreduktaza),
fotosintetičkog aparata itd.
Ovaj materijal je namenjen za učenje i pripremu, ne za predaju.
Slični dokumenti



























































