
Optimizacija direktne LSC metode za detekciju 14C u vodi Pregled
UNIVERZITET U NOVOM SADU
PRIRODNO-MATEMATIČKI
FAKULTET
DEPARTMAN ZA FIZIKU
Optimizacija direktne LSC metode za detekciju
14
C u
vodi
- diplomski rad -
Mentor
: prof. dr Nataša Todorović
Student
: Sonja Vidović
Novi Sad, April 2022.
1
Zahvaljujem se svojoj mentorki prof. dr Nataši Todorović koja mi je pružila priliku da
učestvujem u realizaciji ovog eksperimenta, koja je bila tu da mi prenese znanje i da mi da
korisne sugestije prilikom samog eksperimenta, kao i pri pisanju ovog rada. Takođe se
zahvaljujem i prof. dr Ivani Stojković, prof. dr Jovani Nikolov i mast. hem. Branislavi
Tenjović na svoj pomoći.
Pored zahvalnosti za svu pomoć prilikom izrade i pisanja samog rada, dugujem zahvalnost
i samoj Katedri za nuklearnu fiziku i svim njenim profesorima i asistentima koji su mi
prenosili svoje znanje u toku studija i koji su zaslužni za moju ljubav prema nuklearnoj
fizici, koji su uvek bili tu da odgovore na studentske nedoumice i da mi daju korisne savete.
Veliku zahvalnost dugujem i svim sebi bliskim ljudima koji su bili tu da me podrže u toku
mojih studija.

3
Uvod
Tehnika tečne scintilacione spektroskopije - LSC je jedna od metoda detekcije i analize
zračenja. Cilj ovog rada je bila optimizacija metode direktnog merenja koncentracija
aktivnosti za izotop
14
C u vodi kako bismo imali brzu i efikasnu metodu koja može da se
upotrebljava u slučajevima kada nam je potrebna brza detekcija, kao npr. u slučaju
havarija na nuklearnim postrojenjima.
U eksperimentalnim merenjima koja su izvršena u ovom radu kao LSC detektor
korišćen je Quantulus 1220
TM
. On je niskofonski detektor koji nam omogućava
ispitivanja veoma niskih nivoa radioaktivnosti (veštačkih, kosmičkih i drugih prirodnih
radionuklida). Zbog toga što je sam detektor konstruisan od niskoaktivnih materijala
omogućena su datiranja izotopom
14
C, kao i precizna merenja niskih radioaktivnosti u
okolini [1], što je upravo i glavni razlog korišćenja ovog detektora za merenje niskih
nivoa aktivnosti
14
C i u vodi. Kako je ovaj izotop čist beta emiter, u ovom radu smo dali i
objašnjenje beta čestica, njihovog raspada, kao i energetskog spektra. Takođe smo dali i
opštu sliku o nivou aktivnosti izotopa
14
C prisutnom u prirodi, što nam govori i koje su
moguće metode njegovog monitoringa i upotrebe.
Princip detekcije zračenja kod LSC detektora bazira se na pojavi fluorescentne
emisije u rastvorima organskih jedinjenja prilikom izlaganja nuklearnoj radijaciji,
prilikom čega dolazi do rezonantnog energetskog transfera od pobuđenih molekula
rastvarača do rastvorenih molekula koji emituju fluorescentnu svetlost. Fluorescentnu
svetlost, koja je posledica deekscitacije organskih molekula, moguće je konvertovati
fotomultiplikatorskim cevima u električne impulse, koji se zatim vode do programa za
obradu signala [1].
Metoda tečne scintilacione spektroskopije je veoma pogodna prilikom analize
voda zbog direktnog kombinovanja uzorka sa tečnim scintilacionim koktelom, zbog
manje zahtevne pripreme uzorka i veće efikasnosti brojanja [1]. Upravo zbog ovoga, u
ovom radu je izvršena optimizacija direktne LSC metode za detekciju
14
C u vodi, koja
može da nam služi za redovni monitoring podzemnih i otpadnih voda iz nuklearnih
elektrana na izotop
14
C, ali pre svega, u slučaju bilo kakvih nuklearnih katastrofa imamo
metodu kojom je moguće na brz, efikasan i jednostavan način odrediti nivoe zračenja
kojim su kontaminirane vode u životnoj sredini. Opisan je način pripreme uzoraka,
predstavljeni su uopšteni postupci optimizacije sistema, kao i relevantni parametri koje
smo posmatrali, a zatim su dati podaci merenja i tumačenja dobijenih rezultata.
4
1.
Radioaktivni ugljenik,
14
C
1.1
14
C u prirodi i osnovne karakteristike
Izotopi su atomi istog elementa koji imaju jednak broj protona, a različit broj neutrona.
Ugljenik je jedan od prvih otkrivenih hemijskih elemenata u prirodi i može da se nađe u
obliku tri izotopa
12
C,
13
C i
14
C. Najzastupljeniji izotop ugljenika u prirodi je
12
C i njega
čini šest protona i šest neutrona. Drugi, teži izotop ugljenika je
13
C i on ima šest protona
i sedam neutrona. Oba izotopa,
12
C i
13
C, su stabilni izotopi, što znači da ne doživljavaju
spontanu transformaciju u neki drugi ugljenikov izotop ili neki drugi element. Odnosno,
jezgra ova dva izotopa nisu radioaktivna. S druge strane, ugljenikov izotop
14
C, koji se
drugačije naziva i radiokarbon, ima šest protona i osam neutrona i jeste radioaktivan, te
stoga predstavlja predmet izučavanja nuklearne fizike [3].
Pojava izotopa
14
C u prirodi je prvi put primećena 1946. godine. Ovaj izotop se u
prirodi obrazuje u gornjim delovima atmosfere, putem nuklearne reakcije [4]:
?
7
14
+ ? →
?
6
14
+ ?
(1.1)
?
7
14
– stabilni izotop azota,
?
– termalni neutron,
?
6
14
– radioaktivni ugljenik koji
dobijamo kao produkt reakcije,
?
– proton, koji je takođe produkt reakcije.
Termalni neutroni koji su nam neophodni za odvijanje ove nuklearne reakcije se
stvaraju putem interakcije visoko energetskog kosmičkog zračenja sa molekulima u
gornjim slojevima atmosfere. Nakon što su stvoreni termalni neutroni oni reaguju sa
atomima azota koji se prirodno nalaze u atmosferi i kao produkt reakcije dobijamo
14
C.
Kako se ova reakcija dešava u prirodi, dobijeni
14
C vrlo brzo oksidiše prilikom čega
dolazi do stvaranja
14
CO
2
, koji se meša sa CO
2
, ugljen-dioksidom koji nije radioaktivne
prirode. Ovo znači da svi živi organizmi, biljke i životinje, sadrže u sebi radioaktivni
ugljenik u otprilike istoj količini u kojoj se on nalazi i u vazduhu [4]. S tim da treba
napomenuti da su ovo veoma male koncentracije, s obzirom da otprilike 99% ugljenika
u prirodi čini
12
C, a skoro 1% čini
13
C [3].
Slika 1.1:
Poreklo i distribucija
14
C u prirodi [4]
6
Jedan od osnovnih načina na koji beta čestice gube energiju je putem jonizacije
2
.
Beta čestice imaju identičnu masu kao i orbitalni elektroni sa kojima interaguju. To
znači da beta čestice ne zadržavaju stalni pravac kretanja, nego bivaju skrenute. Iz tog
razloga putanja beta čestica je izlomljena linija i njihov domet se znatno razlikuje od
dužine traga, odnosno pređenog puta čestice[6]. Domet im je obično
10 ??
u vazduhu, u
zavisnosti od energije koju poseduju, ili nekoliko milimetara u materijalima većeg
rednog broja, npr. aluminijum [7].
Dve vrste beta čestica, pozitroni i elektroni, gotovo na identičan način reaguju sa
materijom. Jedina značajna razlika se sastoji u tome da kada elektroni gube svoju
kompletnu energiju bivaju zahvaćeni od strane nekog atoma i pretvore se u običan
orbitalni elektron, dok pozitroni kada izgube energiju, doživljavaju anihilaciju sa jednim
elektronom. Tom prilikom obe čestice nestaju, uz stvaranje dva gama kvanta zračenja
od 511 keV, koji se razilaze pod uglom od 180° [6].
1.2.1
Beta raspad
Beta raspad je proces koji ima za posledicu emisiju beta čestica i ovo je ujedno i najčešći
oblik spontane transformacije jezgra. Najveći broj jezgara koji se nalaze na proton-
neutronskoj šemi doživljava beta raspad, nezavisno od toga da li su u pitanju teška ili
laka jezgra.
Slika 1.3: Proton-neutronska šema stabilnosti
[8]
?
– broj neutrona u jezgru
?
– broj protona u jezgru
Jezgra iz oblasti koja se nalazi ispod linije stabilnosti se raspadaju emitujući
negativnu beta česticu, dok jezgra iznad linije stabilnosti emituju pozitrone (pozitivne
beta čestice) ili dostižu stabilno stanje zahvatom orbitalnog elektrona. Neka teža jezgra,
iznad linije stabilnosti, mogu doživljavati alfa raspad [6].
2
Radijacioni gubici su ovde zanemarljivi [6].
7
Periodi poluraspada poznatih beta emitera se kreću u veoma širokom opsegu
veličina,
?
1/2
= [10
−2
?, 4 ∙ 10
12
??????]
. Ukupna energija koja se realizuje u beta
raspadu se takođe kreće u širokom intervalu,
? = [18 ???, 16.6 ???]
. Odavde se moglo
zaključiti da je proces beta raspada mnogo komplikovaniji nego kod alfa raspada [6].
Raderford-Sodijev zakon pomeranja
je definisan 1903. godine. On nam kaže da se
elementi koji emituju beta zračenje vremenom pretvaraju u elemente koji se u
periodnom sistemu nalaze jedno mesto udesno, pri čemu oba, predak i potomak, imaju
jednaku atomsku masu. Ovaj zakon nam ustvari opisuje proces beta raspada pri emisiji
negativne beta čestice:
? →
? + ?
−
?+1
?
?
?
(1.3)
?
– jezgro predak
?
– jezgro potomak
?
– maseni broj jezgra
?
– redni broj (broj protona) jezgra
?
−
- elektron (negativna beta čestica)
S obzirom da se jezgro sastoji od protona i neutrona, a da novonastalo jezgro, putem
beta raspada, u ovom slučaju, ima u svom sastavu jedan proton više, u odnosu na jezgro
pretka, to znači da se emisijom negativne beta čestice jedan neutron iz jegra
transformisao u proton. Pri ovome oba jezgra, predak i potomak, imaju isti maseni broj,
odnosno jednak broj nukleona (zbir protona i neutrona u jezgru), pa možemo da
zaključimo da je u pitanju izobarski proces (
? = ?????.
) [6].
Otkrićem veštačke radioaktivnosti, 1936. godine, došlo je do otkrića beta raspada
prilikom kog se kao beta čestica emituje pozitron. Ovde je isto u pitanju izobarski
proces, ali se ovom prilikom jedan proton iz jezgra transformiše u neutron, pa jezgro
potomak u svom sastavu ima jedan proton manje od jezgra pretka [6]:
? →
? + ?
+
?−1
?
?
?
(1.4)
?
+
- pozitron (pozitivna beta čestica)
Daljim proučavanjem otkriveno je da je moguć slučaj da jedno nestabilno jezgro
zahvati jedan od orbitalnih elektrona (najčešće sa K ljuske), prilikom čega od jednog
protona iz unutrašnjosti jezgra i jednog zahvaćenog orbitalnog elektrona nastaje
neutron. Tada, jezgro potomak u svom sastavu ima jedan proton manje. Ovaj proces je
takođe izobarski jer mu se, kao ni kod prethodna dva, ne menja maseni broj.
Elektronski
zahvat
ili
K zahvat
:
? + ?
−
→
?
?−1
?
?
?
(1.5)
Nakon zahvata elektrona primećuje se zračenje karakteristično za optički spektar atoma
potomka, po čemu možemo i da prepoznamo ovaj proces. Do ovog zračenja dolazi pošto
se na upražnjeno mesto na K ljusci spušta elektron sa neke od viših orbitala, pa se ovim
putem rešava viška svoje energije [6].

9
Iz zakona održanja energije dobijamo uslove koji moraju da budu zadovoljeni da bi se
beta raspad mogao odigrati. Za negativni beta raspad uslov je:
?
??
(?, ?) > ?
??
(?, ? + 1)
(1.6)
Uslov za pozitronski raspad:
?
??
(?, ?) > ?
??
(?, ? − 1) + 2?
?
(1.7)
Uslov za zahvat elektrona:
?
??
(?, ?) > ?
??
(?, ? − 1)
(1.8)
Sve mase koje učestvuju u raspadu su veoma striktno određene. Odavde se moglo
očekivati da će sve beta čestice koje se emituju u raspadu jednog radioizotopa imati istu
energiju, ako se jezgro potomak stvara u osnovnom energetskom stanju. Takođe,
pretpostavka je bila da ukoliko imamo slučaj da se jezgro potomak stvara u pobuđenim
energetskim stanjima tada bi beta čestice po energijama bile podeljene u nekoliko
grupa, a jezgro bi se viška energije oslobađalo emisijom gama zračenja (slika 1.5). Tom
prilikom energetski spektar beta čestica bi bio diskretnog karaktera i sastojao bi se od
nekoliko linija [6].
Nakon eskperimentalnih merenja beta spektara ustanovljeno je da pretpostavka
nije bila dobra, jer se dobijao kontinualni oblik beta spektra emitovanih čestica [6].
Slika 1.6: Energetski spektar negativnih beta čestica izotopa
210
Bi
[10]
Merenjima je ustanovljeno da beta čestice imaju sve moguće energije od nulte, pa sve do
neke maksimalne vrednosti, koja odgovara razlici energetskih stanja koja poseduju
učesnici na početku i po okončanju raspada [6].
Ustanovljeno je da samo zanemarljiv broj beta čestica u raspadu odnosi
kompletnu energiju koja im stoji na raspolaganju, a sve ostale čestice imaju energiju
koja je manja od nje. Pretpostavka da beta čestice dele energiju sa gama fotonima u svim
mogućim iznosima nije bila održiva, jer bi u tom slučaju i gama zračenje moralo imati
kontinuiran spektar, a znamo da to nije slučaj, jer je u pitanju linijski spektar. Pored
toga, tu je i činjenica da i prilikom stvaranja jezgra potomka u osnovnom stanju, kada
nemamo emisiju gama fotona, spektar beta čestica je i dalje kontinualan [6].
10
Tek 1930. godine je Pauli dao teorijsko objašnjenje ovog problema koje je imalo
smisla, ali se na eksperimentalnu potvrdu, kada je i potvrđena ova pretpostavka, moralo
čekati još 24 godine [6].
Paulijeva pretpostavka je bila da se prilikom emisije beta čestice emituje još
jedna čestica kojoj je dao naziv
neutrino.
U ovom slučaju emitrovani elektron (pozitron)
i neutrino bi podelili ukupnu energiju raspada koja im stoji na raspolaganju u svim
mogućim iznosima, što konačno daje za posledicu kontinualni beta spektar. Ova
pretpostavka je na kraju i potvrđena, ali se na potvrdu moralo duže čekati zbog osobine
neutrina da veoma slabo reaguje sa materijom, što je istraživačima otežalo samu
njegovu detekciju. Takođe, iz zakona održanja momenta impulsa, po Dirakovoj teoriji
neutrino mora da ima i antičesticu –
antineutrino.
Antineutrino se od neutrina razlikuje
isključivo po načinu na koji se međusobno odnose vektori momenta impulsa i pravca
kretanja. Usvojeno je da su kod neutrina ova dva vektora antiparalelna, dok su kod
antineutrina paralelni [6].
Sada, procese beta raspada možemo da zapišemo u odgovarajućoj formi [6].
Negativni beta raspad pišemo u obliku:
? → ? +
? + ?̃
−1
0
1
1
0
1
(1.9)
Zapis pozitronskog beta raspada:
? → ?
0
1
+
?
+1
0
+ ?
1
1
(1.10)
Elektronski zahvat:
?
1
1
+
?
−1
0
→ ?
0
1
+ ?
(1.11)
?
0
1
– neutron
?
1
1
– proton
?
−1
0
– elektron
?̃
– antineutrino
?
+1
0
– pozitron
?
- neutrino
1.3
Radioaktivno datiranje
Radioaktivno datiranjem putem izotopa
14
C je primenjivo samo na organske i neke
neorganske materijale (ne primenjuje se na metale). Glavna tri principa za datiranje su
putem gasnih proporcionalnih detektora, tečne scintilacione spektroskopije i
akceleratorske masene spektroskopije [12].
Datiranje izotopom
14
C je metod koji nam obezbeđuje objektivnu procenu
starosti materijala poteklih od živih organizama, u čijem sastavu se nalazi ugljenik.
Takvi materijali su npr. fosilni ostaci. Starost može da se proceni merenjem količine
izotopa
14
C koji je prisutan u uzorku i njegovim poređenjem sa internacionalno
korišćenim referentnim standardom [12].
Zbog uticaja tehnike radioaktivnog datiranja na modernog čoveka ovo je bilo
jedno od najznačajnijih otkrića 20. veka. Arheologija i druge antropološke nauke koriste
datiranje radioaktivnim ugljenikom da potvrde ili opovrgnu svoje teorije. Tokom godina

12
Ovo znači da je veoma lako razlučiti materijal koji datira od pre nuklearnih testiranja i
posle njega metodom datiranja izotopom
14
C [16].
Drugi značajni veštački efekti bitni za datiranje radioaktivnim ugljenikom su
posledice sagorevanja fosilnih goriva. Ovo ima za posledicu ispuštanje velikih količina
ugljen-dioksida u atmosferu koji uopšte ne sadrži izotop
14
C. Razlog za potpuni
izostanak ovog izotopa kod fosilnih goriva je ta što organski materijal od kog su nastala
fosilna goriva je jako star. To znači da dolazi do promene odnosa izotopa
12
C:
14
C u
atmosferi. Ovaj efekat je poznat pod nazivom “
Suess effect
”. Delimično zbog ovoga, je
veoma teško datirati materijal u periodu od 1650. do 1950. godine [16].
1.4.1
Proizvodnja
14
C u nuklearnim reaktorima
14
C se veštački proizvodi u svim vrstama nuklearnih reaktora nuklearnim reakcijama
zahvata termalnih neutrona na izotopima ugljenika, azota i kiseonika prisutnih u
nuklearnom gorivu, oblogama reaktora, rashladnoj tečnosti, moderatorima, kao i u
materijalima od kojih je izgrađen reaktor. Frakcija generisanog
14
C oslobađa se
kontinuirano tokom normalnog rada nuklearnih elektrana, uglavnom u dva hemijska
oblika: procesima oksidacije kao ugljen-dioksid (CO
2
) i procesima redukcije, najčešće u
obliku CH
4
. U svim vrstama reaktora
14
C se emituje u okolinu u obliku
14
CO
2
[1].
Nuklearne reakcije koje dovode do nastanka
14
C u reaktorima su [1]:
14
N(n,p)
14
C koja nastaje zahvatom termalnih neutrona na jezgima
14
N (nuklearni
presek za reakciju je 1,83 barna)
17
O(n,
)
14
C koja nastaje zahvatom termalnih neutrona na jezgima
17
O (nuklearni
presek za reakciju je 0,24 barna)
13
C(n,
)
14
C reakcija sa malom vrednošću nuklearnog preseka (0,9∙10-3 barna)
15
N(n,d)
14
C reakcija sa veoma malom vrednošću nuklearnog preseka (2,5∙10-7
barna)
16
O(n,3He)
14
C reakcija sa veoma malom vrednošću nuklearnog preseka (5,0∙10-8
barna)
Jezgra azota, kiseonika i ugljenika na kojima se nuklearna reakcija odigrava
prisutni su u velikim količinama u nuklearnom gorivu, kao i u oblogama reaktora,
moderatorima, sistemima za hlađenje i materijalima od kojih je reaktor izrađen, bilo kao
sastavni konstituenti ili kao nečistoće. Kao posledica ovoga,
14
C proizveden u
nuklearnim reaktorima može da se direktno ispušta u životnu sredinu u gasovitoj formi
iz uređaja za hlađenje i/ili moderatora, ili u mnogo manjoj količini u tečnom obliku u
vidu tečnih efluenata. U jezgru reaktora
14
C ostaje sve do dekomisije reaktora ili se
zadržava u istrošenom nuklearnom gorivu. Iz nuklearnog goriva
14
C ispušta se u okolinu
u gasovitoj formi [1].
Količina
14
C proizvedena u nuklearnim reaktorima zavisi od obogaćenja goriva,
temperature i relativnih masa goriva, moderatora i sistema za hlađenje, kao i od
koncentracije azotnih nečistoća u tim sistemima [1].
1.5
Monitoring
14
C
Monitoring izotopa
14
C podrazumeva praćenje koncentracije aktivnosti ovog izotopa u
vazduhu, rečnim i podzemnim vodama i on se najčešće vrši u okolini nuklearnih
elektrana ili u okolini mesta gde se odlaže nuklearni otpad. Povećane koncentracije
aktivnosti ovog izotopa, uz tricijum, jedan su od glavnih pokazatelja mogućih havarija
13
na nuklearnim postrojenjima. Iz ovog razloga, veoma je bitno da imamo pouzdane
metode za ispitivanje nivoa
14
C, u različitim uzorcima, u cilju praćenja ispuštanja ovog
radionuklida i kontrolisanja nivoa njegove aktivnosti u okolini [17].
Obično postoje dva sistema za monitoring
14
C koji se ispušta iz nuklearnih
postrojenja. To su sistemi za monitoring otpada i sistemi za monitoring okoline. Sistemi
za monitoring otpada se koriste da se direktno meri nivo
14
C u vazdušnom i tečnom
otpadu pre ispuštanja u okolinu, dok su sistemi za monitoring okoline namenjeni da
mere prirodne nivoe ovog izotopa analizirajući uzorke iz okoline, kao što su npr. uzorci
iz atmosfere i površinskih voda. Ova dva sistema se nadopunjuju. Sistem za monitoring
okoline obezbeđuje tačnu procenu radijacione izloženosti stanovništva, dok sistem za
monitoring otpada obezbeđuje direktne podatke o količini radionuklida i njihovoj vrsti
(da li je u pitanju tricijum ili radioaktivni ugljenik) koji se ispuštaju iz nuklearnih
postrojenja. Stoga, ova dva sistema se često koriste istovremeno [17].

15
2.1
Scintilacioni materijali
Scintilatori su materijali koji u interakciji sa zračenjem, nakon što bivaju pobuđeni ili
jonizovani, emituju vidljivu svetlost, odnosno pokazuju osobinu luminescencije. Većina
njih je neprozirna za sopstvenu svetlost, što znači da apsorbuju iste talasne dužine
svetlosti koju i emituju, što onemogućava da se takvi materijali u celoj svojoj zapremini
koriste kao scintilacioni detektori. Organski scintilatori su prozirni za sopstvenu
svetlost, pa se koriste kao detektori jonizujućeg zračenja [1].
Svi scintilatori se mogu podeliti na: neorganske, organske i gasovite [1].
Neorganski scintilatori su monokristali nekih neorganskih jedinjenja, odnosno
alkalnih metala (alkalnih jodida), koja sadrže malu koncentraciju nečistoća, oko 0,1%.
Ove nečistoće, tzv. aktivatori, dodaju se jer sami kristali nisu prozirni za sopstvenu
svetlost [1].
Gasoviti scintilatori su smeše plemenitih gasova kod kojih atomski prelazi
rezultuju scintilacijama. Pošto emituju svetlost u UV oblasti, dodaju im se gasovi (npr.
azot) koji pomeraju emisioni spektar. Imaju veoma kratko vreme raspada, veoma malu
efikasnost za γ - detekciju, pa se koriste za detekciju teških čestica [1].
Organski scintilatori su aromatična organska jedinjenja (planarni molekuli
benzenovih prstenova), koji mogu biti u kristalnoj formi, ili pak rastvoreni u čvrstoj
prozirnoj plastici ili u organskim tečnostima [1].
Postoji nekoliko vrsta organskih scintilatora: čisti organski scintilatori, plastični i
tečni [1].
Tečni organski scintilatori dobijaju se rastvaranjem primarnih organskih
scintilatora u odgovarajućim rastvaračima, uz eventualni dodatak sekundarnih
rastvorenih scintilatora koji pomeraju emitovani spektar talasnih dužina radi boljeg
poklapanja sa spektralnom osetljivošću PMT-a [1].
2.2
Princip detekcije
Kod molekula tečnosti koje mogu da se upotrebljavaju kao scintilatori svako energetsko
stanje (osnovna i pobuđena) poseduje još veliki broj vibracionih i rotacionih stanja [6].
Prilikom pobude ovakvog molekula na neko više energetsko stanje deo energije
pobude se troši na prelaze između vibracionih nivoa pobuđenog stanja. Prilikom
prelaska molekula sa pobuđenog na osnovno energetsko stanje emituje se foton. Tom
prilikom može se desiti da je energija fotona manja od energije pobude molekula. Ovo
ima za posledicu pomeranje opsega talasnih dužina svetlosti koje se emituju u odnosu
na opseg talasnih dužina svetlosti koje se apsorbuju [6], odnosno kažemo da su ovi
materijali (organski scintilatori) prozirni za sopstvenu svetlost [1].
Emitovana svetlost ima veću talasnu dužinu od apsorbovane svetlosti, što znači
da će emitovana svetlost (nakon što jonizujuće zračenje pobudi molekule organskog
scintilatora) uspeti da izbegne apsorpciju i iznosiće informacije o odigranoj interakciji
[6].
Slika 2.1: Šematiski prikaz detekcije tečnim scintilacionim detektorom
[18]
16
2.3
LSC koktel
Tehnike tečne scintilacione spektroskopije podrazumevaju barem elementarnu
pripremu uzoraka pre merenja – njihovo mešanje sa scintilatorima. Uzorci, koji pre toga
mogu da se prevode u tečno stanje, prekoncentrišu i slično, mešaju se sa raznim
komercijalno dostupnim smešama scintilatora u tečnom stanju, tzv. scintilacionim
koktelima [1].
Bez obzira na tehniku pripreme uzorka, sredina u kojoj se vrše LSC merenja uvek
je scintilacioni koktel, pa su poznavanje karakteristika i odabir pogodnog koktela
suštinski korak u pripremi uzoraka. Uloga rastvarača u LSC koktelu je da apsorbuje
energiju nuklearnih raspada i da rastvori uzorak i dodate scintilatore [1].
LSC tehnika podrazumeva smeštanje radioaktivnog uzorka (rastvorenog u
organskom rastvaraču ili u vodi) u staklene ili plastične bočice, u koje se dodaje
scintilacioni koktel tako da se dobija homogeni rastvor za merenje. Tipični scintilacioni
koktel sadrži rastvarač u kojem je rastvoreno organsko jedinjenje u maloj koncentraciji
[1].
2.4
Procesi koji ometaju LSC detekciju
Postoji nekoliko procesa koji ometaju LSC detekciju, a to su pozadinsko zračenje,
prigušenje u scintilacionim brojačima, smeša radionuklida u jednom uzorku,
luminiscencija, statistički efekti i efekat zidova bočica [1].
Pozadinsko zračenje (
background
), predstavlja odbroje u detektoru koji potiču
od spoljašnjih izvora - kosmičkog zračenja i zračenja iz okruženja, kao i od samog
instrumenta i fotomultiplikatorskih cevi. Prilikom svakog merenja aktivnosti uzorka, od
dobijenog odbroja uzorka treba oduzeti odbroj background-a. Ovaj odbroj dobija se
dovoljno dugim merenjem pripremljenog viala sa scintilacionim koktelom i svim
ostalim hemijskim konstituentima koji se koriste i u pripremi uzoraka (sa istim nivoom
prigušenja kao i analizirani radioaktivni uzorci), izuzev radionuklida koji se ispituje, tj.
pripremamo
blank
(“prazan”) uzorak [1].
Iako u LSC uzorcima nema samoapsorpcije, rastvoreni minerali iz prirodnih voda
mogu apsorbovati emitovane fotone iz scintilatora u procesu prigušenja, a koje redukuje
efikasnost detekcije. Takođe, često se nakon pripreme uzoraka iz životne sredine
dobijaju obojeni uzorci, za koje je neophodno korigovati efikasnost detekcije. Prigušenje
predstavlja gubitak energije u toku njenog prenosa, dakle smanjuje intenzitet fotona
(scintilacija) i efikasnost detekcije radionuklida u scintilacionom koktelu. Postoje tri tipa
prigušenja - jonizaciono, hemijsko i obojeno [2].
Jonizaciono prigušenje odnosi se na redukciju broja gusto pobuđenih molekula
scintilacionog koktela usled njihove interakcije, pa je ono posledica jonizacije
generisane od strane nuklearnog zračenja uz redukciju intenziteta fotona [2].
Transfer energije odvija se u aromatičnom rastvoru u kom su radioaktivni uzorak i
scintilator, i moguće je da prilikom opisanog transfera dođe do hemijskih ili obojenih
prigušenja, tj. do
quench
efekta. Ova prigušenja redukuju efikasnost energetskog
transfera ili uzrokuju apsorpciju fotona [2].
S obzirom na to da svi radionuklidi koji su β-emiteri generišu kontinualni spektar
energija β čestica od 0 do
?
????
, pojaviće se problem u analizi spektara amplituda
ukoliko se uzorak sastoji od smeše više radionuklida, jer će se spektri preklopiti [1].
Luminescencija u tečnim scintilacionim koktelima podrazumeva emisiju fotona
koja prati proces ekscitacije i deekscitacije molekula nakon apsorpcije neke energije

18
Radi postizanja što niže granice detekcije, instrument mora biti stabilan tokom
dugih perioda brojanja, a pozadinski efekti moraju biti maksimalno umanjeni. Niski
nivoi pozadinskog zračenja karakteristični za rad Quantulusa uporedivi su sa nivoima
koji se postižu na instrumentima u podzemnim laboratorijama. Za ovakav režim
Quantulus ima ugrađen sistem redukcije pozadinskog zračenja oko komore sa
bočicama, koji se sastoji od pasivne i aktivne zaštite [1].
19
3
Optimizacija metoda za direktno merenje
14
C u vodi
Prilikom pripreme uzoraka za kalibraciju sistema i optimizaciju metode koristili smo se
Internacionalnim standardom za određivanje aktivnosti
14
C u vodi tehnikom tečne
scintilacione spektroskopije
[ISO 13162:2011(E)].
3.1
Kalibracija sistema
U skladu sa standardom, prvo smo izvršili kalibraciju sistema za merenje
14
C, što ima za
cilj da obezbedi efikasnost detekcije. Kalibraciju sistema smo vršili tako što smo prvo
pripremili
blank
-ove
5
. Priprema
blank
-ova podrazumeva mešavinu vode i permafluora u
različitim odnosima.
Da bismo obezbedili što bolju efikasnost detekcije voda koju koristimo za
pripremu uzoraka treba da bude što manje moguće pozadinskog zračenja
6
i sa što
manje hemijskih nečistoća. To se postiže tako što se koristi podzemna voda, koja zatim
treba da prođe kroz proces destilacije. Destilat se drži u dobro zatvorenoj staklenoj boci
u mraku na konstantnim temperaturama i što je dalje fizički moguće od bilo kakvih
izvora
14
C. Zatim treba da se odredi aktivnost
14
C za ovako pripremljenu vodu i da se
zabeleži datum merenja. Datum merenja beležimo kako bismo, kada budemo koristili
ovako pripremljenu vodu, imali podatak o tačnom nivou aktivnosti
14
C u vodi na taj dan
kada je upotrebljavamo za dalja merenja, jer nam je poznato da se s vremenom
aktivnost smanjuje.
Scintilacioni rastvor koji koristimo se bira u skladu sa karakteristikama uzorka
koji hoćemo da analiziramo i u skladu sa karakteristikama detektora koji ćemo koristiti
za merenja. Neophodno je da koktel bude homogene strukture i stabilan
7
. Potrebno ga
je čuvati na tamnom mestu, kako bi se izbeglo izlaganje sunčevom ili fluorescentnom
svetlu i tako sprečila luminiscencija koja bi u tom slučaju uticala na rezultate merenja.
Mi smo u našem eksperimentu koristili Permafluor E+, jer je za njega poznato da dobro
apsorbuje
14
C, ima mali efekat prigušenja (
quench
), a takođe nam je i bila bitna
dostupnost samog scintilatora.
U skladu sa karakteristikama našeg detektora,
Quantulus 1220
TM
, maksimalna
zapremina uzorka sa kojom možemo da radimo je
20 ??
. U skladu sa tim biramo i
veličinu
viala
8
. Kada govorimo o materijalu od kog se izrađuju viali postoji ih velik broj
na raspolaganju. Najčešće korišćeni materijali su staklo i polietilen (PE). Prednost
staklenih viala je što su providni, pa možemo da vidimo u njegovu unutrašnjost, a mana
im je što imaju u svom sastavu prirodno prisutan izotop
40
K, što znači da uvek imamo
prisutan fon
9
koji potiče od njega. S druge strane, kada govorimo o plastičnim vialima
(PE) neki ogranski rastvarači koji se nalaze u scintilacionim koktelima difunduju kroz
njegove zidove i na taj način ubrzavaju degradaciju same mešavine. Mi smo, u ovom
5
Blank
– uzorak koji merimo, a koji je „slobodan“ od radioaktivnosti i njegova uloga je da nam pokaže
iznos fona koji je prisutan prilikom merenja aktivnih uzoraka.
6
Pozadinsko zračenje -
Background
7
Stabilan – da nije lako podložan hemijskim reakcijama.
8
Vial – bočice za merenje koje posle smeštamo u detektorski sistem.
9
Fon – događaji koje detektor registruje, a posledica su prirodne radioaktivnosti koja je uvek prisutna u
nekoj meri.

21
? = 153166667(5) ∙ 10
−7
???
??
Ovim nam je data ukupna aktivnost standarda po
1 ??
. S obzirom da smo mi za merenje
koristili zapreminu standarda od
20??
, sledilo je računanje i odgovarajuće aktivnosti.
Vrednost aktivnosti za zapreminu od
? = 20 ??
je:
?
20
= ? ∙ ?
?
20
= 306.33 ??
11
Vrednost pripadajuće greške se računa po formuli:
?(?
20
) = √(
??
20
??
∙ ?(?))
2
+ (
??
20
??
∙ ?(?))
2
(3.1)
?(?
20
) = √(? ∙ ?(?))
2
+ (? ∙ ?(?))
2
(3.2)
?(?) = 0.5 ??
– instrumentalna greška za zapreminu
Dobijena vrednost greške za ukupnu aktivnost zapremine:
?(?
20
) = 7.66??
?
20
= 306(8)??
Kod kalibracionih (aktivnih) uzoraka smo napravili odnose voda:permafluor iste
kao kod
blank
-ova.
Nakon što smo na ovaj način pripremili
blank
-ove i kalibracione uzorke prvo smo
stavili na merenje kalibracioni uzorak, jer je njegova aktivnost poznata, a nakon njega i
blank
-ove. Tom prilikom je bilo potrebno zadati detektoru parametre za merenje.
Aktivni uzorci su stavljeni na merenje po 3 ciklusa, od po 30 minuta, pri čemu smo za
PAC
12
(
Pulse Amplitude Comparator
) uzeli vrednost 100. Protokol za merenje i snimanje
spektra smo pravili u programu
WinQ.
Nakon što su završena merenja za aktivni uzorak
napravljen je i protokol za
blank
. Ovde smo imali po jedan ciklus od 300 minuta, a
vrednost za PAC je bila ista kao kod aktivnih uzoraka.
11
Bq – Bekerel (raspad u sekundi)
12
PAC – komparator visine signala
22
Analiza podataka se vrši u paketu za obradu spektra
EasyView
i dobili smo sledeće
rezultate:
Tab. 3.1: Aktivni uzorak
Tab. 3.2: Blank
?: ?[??: ??]
?
?
[?
−1
]
?(?
?
) [?
−1
]
?: ? [??: ??]
?
?
[?
−1
]
?(?
?
) ∙ 10
−2
[?
−1
]
3:17
205.75
0.34
3:17
0.04
0.16
3:17
205.84
0.34
4:16
0.04
0.15
3:17
205.87
0.34
5:15
0.04
0.16
4:16
267.09
0.39
6:14
0.04
0.16
4:16
267.84
0.39
7:13
0.04
0.15
4:16
267.53
0.39
8:12
0.04
0.15
5:15
258.74
0.38
9:11
0.04
0.14
5:15
258.16
0.38
10:10
0.03
0.14
5:15
258.35
0.38
11:9
0.04
0.14
6:14
296.84
0.41
12:8
0.04
0.14
6:14
296.94
0.41
13:7
0.03
0.14
6:14
296.65
0.41
14:6
0.03
0.13
7:13
276.35
0.40
15:5
0.03
0.14
7:13
276.42
0.40
16:4
0.03
0.13
7:13
276.07
0.40
17:3
0.03
0.12
8:12
271.64
0.39
8:12
271.88
0.39
8:12
270.97
0.39
9:11
263.60
0.39
9:11
262.64
0.39
9:11
261.70
0.39
10:10
270.27
0.39
10:10
269.41
0.39
10:10
269.77
0.39
11:9
259.00
0.38
11:9
257.66
0.38
11:9
258.28
0.38
12:8
273.90
0.40
12:8
273.51
0.39
12:8
273.62
0.39
13:7
270.92
0.39
13:7
271.19
0.39
13:7
270.16
0.39
14:6
264.63
0.39
14:6
264.24
0.39
14:6
264.69
0.39
15:5
251.63
0.38
15:5
250.43
0.38
15:5
250.29
0.38
16:4
254.43
0.38
16:4
252.62
0.38
16:4
251.46
0.38
17:3
271.22
0.39
17:3
268.13
0.39
17:3
269.49
0.39

24
Rezultate prikazujemo na sledećem grafiku:
Grafik 3.1: Grafički prikazani kalibracioni podaci za merenje aktivnosti
14
C
Prema rezultatima vidi se da je najveća efikasnost detekcije (najveći odbroj) dobijen za
odnos voda:permafluor za 6:14, pa u narednim merenjima koristimo ovaj odnos. Pored
ovog odnosa, uzimali smo takođe i odnos 10:10, što se preporučuje verovatno iz razloga
što povećavanje zapremine ekoloških uzoraka u vialima može zamutiti pripremljenu
smešu uzorak+koktel (dobijaju se mlečno beli uzorci), što bi redukovalo efikasnost
detekcije. Takođe, povećanje zapremine uzorka vode povećava i nivo prigušenja [2].
3.2
Podešavanje PAC parametra
Na početku, kada smo vršili kalibraciju sistema uzimali smo vrednost za PAC da je 100,
jer je to u tom momentu bila najbolja pretpostavka koju smo mogli da damo. Kako smo
uspešno odredili maksimum efikasnosti detekcije, dalje je sledilo određivanje optimalne
vrednosti PAC-a za odnose (voda:permafluor) 6:14 i 10:10.
Ponovo smo pravili uzorak poznate aktivnosti
14
C i
blank
, ali sada samo u dva
odnosa voda:permafluor koja su nam potrebna. Prilikom pravljenja protokola smo
promenili parametre po kojima merimo, odnosno zadali smo detektoru da meri uzorke
za vrednosti PAC-a u opsegu [1, 240]. Kako su najčešće vrednosti PAC-ova koje se
dobijaju u intervalu [50, 150], u tom intervalu smo uzeli da nam korak bude 10, a ispod i
iznad te granice korak nam je bio 30. Pri ovome smo merili iste uzorke samo za različite
vrednosti PAC-a.
200
220
240
260
280
300
320
2
4
6
8
10
12
14
16
18
Od
br
oj
akt
iv
nog
uz
or
ka
[
cp
s]
Zapremina vode u uzorku [ml]
25
Dobili smo sledeće rezultate:
Tab. 3.4: Odbroji za odnos 6:14 za različite vrednosti PAC-a
???
?
?
[?
−1
]
?(?
?
) [?
−1
]
?
?
[?
−1
]
?(?
?
) ∙ 10
−2
[?
−1
]
1
290.82
0.41
0.03
0.14
30
290.72
0.41
0.03
0.14
60
290.14
0.41
0.03
0.14
70
288.06
0.41
0.03
0.13
80
288.18
0.41
0.03
0.13
90
287.75
0.41
0.03
0.13
100
287.72
0.41
0.03
0.13
110
286.44
0.41
0.03
0.13
120
284.93
0.40
0.03
0.13
130
284.26
0.40
0.03
0.13
140
284.97
0.40
0.03
0.13
150
283.04
0.40
0.03
0.12
180
278.60
0.40
0.03
0.12
210
266.01
0.39
0.03
0.12
240
225.23
0.36
0.02
0.11
Tab. 3.5: Odbroji za odnos 10:10 za različite vredosti PAC-a
PAC
?
?
[?
−1
]
?(?
?
) [?
−1
]
?
?
[?
−1
]
?(?
?
) ∙ 10
−2
[?
−1
]
1
260.85
0.39
0.03
0.13
30
260.76
0.39
0.03
0.13
60
259.25
0.38
0.03
0.13
70
259.08
0.38
0.03
0.13
80
258.61
0.38
0.03
0.13
90
257.28
0.38
0.03
0.13
100
257.35
0.38
0.03
0.13
110
255.63
0.38
0.03
0.13
120
255.62
0.38
0.03
0.13
130
253.41
0.38
0.03
0.13
140
253.09
0.38
0.03
0.13
150
251.65
0.38
0.03
0.13
180
247.06
0.38
0.03
0.12
210
234.47
0.37
0.02
0.12
Na osnovu ovih rezultata računali smo efikasnost (
?
) i FOM
13
za svaku vrednost PAC-a,
po formulama:
? =
?
?
− ?
?
?
20
∙ 100 [%]
(3.7)
13
FOM – Figure of Merit
(faktor dobrote)

27
Optimalnu vrednost PAC-a za odnos 6:14 i 10:10 određujemo sa sledećeg grafika:
Grafik 3.2: Zavisnost FOM faktora od vrednosti PAC-a
Optimalna vrednost PAC parametra je ona za koju dobijamo maksimum FOM
faktora. Sa grafika možemo da vidimo da je za odnos
????: ?????????? = 6: 14
najveća
vrednost FOM-a za vrednost
??? = 150
, dok za odnos
10: 10
maksimum funkcije
odgovara vrednosti
??? = 120
.
3.3
Optimizacija mernog prozora
Prilikom očitavanja rezultata merenja u programu
EasyView
možemo da vidimo i oblik
spektra koji dobijamo tom prilikom.
O
d
b
ro
j
[?
−
?
]
Broj kanala
Slika 3.2: Izgled kalibracionog spektra za standard
14
C
Ovde nam je spektar prikazan na kanalima od u opsegu [1, 1024]. S obzirom da
ovo obuhvata sve kanale trebalo je zatim da izvršimo optimizaciju mernog prozora - ROI
(
Region of Interest
). To znači da pomičemo granice prozora prema unutrašnjosti spektra
što ima za posledicu smanjenje odbroja osnovnog zračenja, ali se istovremeno smanjuje
i odbroj koji potiče od uzorka. Pomeranjem donje i gornje granice trebalo je da
28
pronađemo takav prozor u kojem će se, što je više moguće, sniziti uticaj osnovnog
zračenja, a da istovremeno ne gubimo značajan deo
14
C spektra.
Prilikom posmatranja dobijenog spektra u programu
EasyView
videli smo da su
nam početak i kraj spektra otprilike u opsegu [150, 650]. Kako bismo mogli izvršiti
optimizaciju prozora bilo je neophodno odrediti FOM faktor i efikasnost detekcije za
opsege koji uključuju različite kanale. Mi smo ovde odredili da ćemo da merimo za
opseg [1, 1024] i opseg [150, 650].
FOM faktori i efikasnost detekcije koje smo odredili u prethodnom poglavlju ne
možemo da primenimo ovde, jer smo njih određivali u svrhu optimizacije vrednosti
PAC-a, pa smo imali i različite početne merne parametre.
3.3.1
Kalibracija sistema za optimalni ROI
U svrhu kalibracije sistema pripremali smo aktivne uzorke za odnose 6:14 i 10:10. Ove
uzorke smo pripremali tako da imaju različite poznate aktivnosti za široki raspon
vrednosti. Da bismo mogli da dobijemo vrednosti aktivnosti koje su nam potrebne
prethodno smo pripremili smešu u dva viala. U prvi vial koji smo pripremali smo
stavljali
0.1 ??
razblaženog standarda
14
C u
20 ??
vode.
Aktivnost po zapremini smo računali po formuli:
?
?1
=
? ∙ ?
14
?
?
(3.11)
? = 153166667(5) ∙ 10
−4 ???
??
– aktivnost razblaženog standarda
?
14
?
– zapremina razblaženog standarda
?
– ukupna zapremina smeše
Za vial 1 dobijamo vrednost:
?
?1
= 76.20
??
??
Pripadajuću grešku računamo po formuli:
?(?
?1
) = √(
??
?1
??
∙ ?(?))
2
+ (
??
?1
??
14
?
∙ ?(?))
2
+ (
??
?1
??
∙ ?(?))
2
(3.12)
?(?
?1
) = √(
?
14
?
?
∙ ?(?))
2
+ (
?
?
∙ ?(?))
2
+ (
??
14
?
?
2
∙ ?(?))
2
(3.13)
?(?) = 0.5 ??
– instrumentalna greška za zapreminu
Verovatna greška za vial 1:
?(?
?1
) = 0.38 ∙ 10
−2
??
??
?
?1
= 76202(4)
??
?

30
Za pripremanje aktivnih uzoraka za ovu kalibraciju koristili smo vrednosti iz
sledeće tabele:
Tab. 3.7: Priprema uzoraka za kalibraciju
6:14
10:10
?
14
?
[??]
?
?
2
?
[??]
?
?
[??/?]
?
14
?
[??]
?
?
2
?
[??]
?
?
[??/?]
vial 2
0.08
5.92
5.06
0.1
9.9
3.79
0.35
5.65
22.12
0.5
9.5
18.96
1.3
4.7
82.14
1.5
8.5
56.87
4
2
252.74
5
5
189.56
vial 1
0.07
5.93
889.03
0.1
9.9
762.02
0.3
5.7
3810.12
0.5
9.5
3810.11
0.7
5.3
8890.27
1
9
7620.2
Nakon snimanja ovako pripremljenih uzoraka i računanja srednjih vrednosti
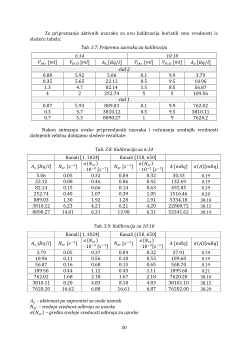
dobijenih velična dobijamo sledeće rezultate:
Tab. 3.8: Kalibracija za 6:14
Kanali [1, 1024]
Kanali [150, 650]
?
?
[?? ?
⁄ ]
?
??
[?
−1
]
?(?
??
)
∙ 10
−2
[?
−1
]
?
??
[?
−1
]
?(?
??
)
∙ 10
−2
[?
−1
]
? [???]
?(?)[???]
5.06
0.05
0.32
0.04
0.32
30.33
0.19
22.12
0.08
0.46
0.06
0.42
132.69
0.19
82.14
0.15
0.66
0.14
0.63
492.85
0.19
252.74
0.40
1.07
0.39
1.05
1516.46
0.20
889.03
1.30
1.92
1.28
1.91
5334.18
38.10
3810.12
6.23
4.21
6.21
4.20
22860.72
38.12
8890.27
14.01
6.31
13.98
6.31
53341.62
38.19
Tab. 3.9: Kalibracija za 10:10
Kanali [1, 1024]
Kanali [150, 650]
?
?
[?? ?
⁄ ]
?
??
[?
−1
]
?(?
??
)
∙ 10
−2
[?
−1
]
?
??
[?
−1
]
?(?
??
)
∙ 10
−2
[?
−1
]
? [???]
?(?)[???]
3.79
0.05
0.37
0.04
0.32
37.91
0.19
18.96
0.11
0.56
0.10
0.53
189.60
0.19
56.87
0.16
0.68
0.15
0.65
568.70
0.19
189.56
0.44
1.12
0.43
1.11
1895.60
0.21
762.02
1.68
2.18
1.67
2.18
7620.20
38.10
3810.11
8.20
4.83
8.18
4.83
38101.10
38.15
7620.20
16.62
6.88
16.61
6.87
76202.00
38.29
?
?
– aktivnost po zapremini za svaki uzorak
?
??
– srednja vrednost odbroja za uzorke
?(?
??
)
– greška srednje vrednosti odbroja za uzorke
31
?
– ukupna aktivnost uzorka
?(?)
–greška aktivnosti uzorka
Na osnovu ovih podataka smo crtali grafike zavisnosti odbroja od ukupne
aktivnosti u cilju određivanja efikasnosti detekcije.
Odnos 6:14 za prozor [1, 1024]:
Grafik 3.3: Određivanje efikasnosti za odnos 6:14 u opsegu [1, 1024]
?
?:??
= ??. ??%
??? =
?
2
?
?[1,1024]
(3.14)
?
?
= 0.044 ?
−1
– odbroj blank-a za odnos 6:14 u opsegu [1,1024] za PAC=100
???
?:??
= ?. ??
Odnos 6:14 za prozor [150, 650]:
Grafik 3.4: Određivanje efikasnosti za odnos 6:14 u opsegu [150, 650]

33
?
?
= 0.027 ?
−1
-
odbroj blank-a za odnos 10:10 u opsegu [150, 650] za PAC=120
???
??:??
= ?. ??
Tabelarni prikaz dobijenih podataka:
Tab. 3.10: Selekcija optimalnog prozora za date odnose
?????
? [%]
?
?
[?
−1
]
???
6:14
1-1024
26.40
(12)
0.044
1.58
150-650
26.34
(12)
0.026
2.67
10:10
1-1024
21.76
(10)
0.034
1.39
150-650
21.74
(10)
0.027
1.75
Odavde smo videli da maksimalnu vrednosti FOM faktora dobijamo za odnos
6:14 u opsegu [150, 650], što ukazuje na to da bi u tom opsegu trebalo da nam je
optimalan merni prozor. S druge strane kada pogledamo vrednosti efikasnosti za odnos
6:14 vidimo da se vrednosti ne razlikuju mnogo i da su
? ≈ 26%
.
Još na početku kada smo merili smo procenili da će nam efikasnost merenja biti
najveća za odnos 6:14, ali smo uzeli da merimo i odnos 10:10 da bismo videli kakve
ćemo rezultate tu dobiti. Kao što smo pretpostavili, ispostavlja se da efikasnost zaista
jeste manja i da iznosi
? ≈ 22%
. Posmatrajući FOM faktor, i u ovom slučaju dobijamo da
nam je veća vrednost u opsegu [150, 650], pa zaključujemo da nam tu i leži optimalni
merni prozor.
3.4
Određivanje MDA
MDA (minimalna detektabilna aktivnost) se računa po sledećoj formuli:
??? =
2.71 + 4.65√?
?
∙ ?[???]
60 ∙ ? ∙ ? ∙ ?[???]
[
??
?
]
(3.15)
?
– vreme merenja blank-a
Uvrštavanjem podataka za odbroj
blank
-a, kao i vreme njegovog merenja i efikasnosti
koje smo dobili optimizacijom metode možemo da vidimo koja je granica naše detekcije
i u kojim slučajevima ovaj metod može da nam bude najviše od koristi.
U tabeli 3.11 imamo prikazane vrednosti za MDA za merenja uzoraka po
300 ??????,
zapremine
20 ??
:
Tab. 3.11: Vrednosti MDA za različite uzorke
uzorak
?
?
[???]
?
[%]
MDA
[Bq/l]
6:14 za 1-1024
1.56
26.40
(12)
1.09
10:10 za 1-1024
1.62
21.76
(10)
1.34
Posmatrali smo analizu sadržaja
14
C, gde smo merili neaktivni uzorak, za odnos 6:14, za
vreme od 300 min. U tom slučaju smo dobili da nam je ukupni odbroj
? = 468
, što znači
34
da nam je nivo pozadinskog zračenja, odnosno
blank
?
?
= 1.56 ???
. Efikasnost
detekcije u ovom slučaju nam je
? = 26.34%
, a zapremina uzorka
? = 20 ??
.
Uvrštavanjem ovih vrednosti u formulu dobija se da je
??? = 1.09 ?? ?
⁄
.
Što nam je duže vreme merenja to će nam MDA faktor biti sve manji. Prilikom
merenja cilj nam je da dobijemo zadovoljavajuću vrednost za MDA, a istovremeno i da
skratimo vreme merenja koliko je moguće.
U tabeli 3.12 imamo prikazane vrednosti za MDA za merenja uzoraka po
30 ??????,
zapremine
20 ??
:
Tab. 3.12: Vrednosti MDA za različite uzorke
uzorak
?
?
[???]
?
[%]
MDA
[Bq/l]
6:14 za 150-650
2.64
26.34
(12)
4.64
10:10 za 150-650
2.04
21.74
(10)
4.99
Iz podataka u tabeli 3.12 vidimo da smo pri merenjima od 30 min dobili veće
vrednosti za MDA. Za
????? ????: ?????????? = 6: 14
, na kanalima u opsegu [150-
650], dobili smo da nam je
??? = 4.64 ??/?
. Kao što smo spomenuli, pri merenjima se
gleda da se dobiju što su niže vrednosti moguće, ali to nam oduzima i dodatno vreme.
Ipak, s obzirom da zakonska regulativa Republike Srbije kaže da su dopuštene količine
aktivnosti u pijaćoj vodi za izotop
14
C do
? = 240 ??/?
[19], vidimo da nam je vreme
merenja od 30 minuta i više nego dovoljno za monitoring voda.
3.5
Zaključak
Ovaj rad je imao za cilj optimizaciju direktne metode za merenje koncentracije
aktivnosti izotopa
14
C u vodi putem tečne scintilacione spektroskopije. Za merenja
izvršena prilikom izrade ovog rada korišćen je LSC detektor Quantulus 1220
TM
. U
pitanju je niskofonski detektor, te je stoga bio pogodan za merenje ovog radioizotopa.
Izotop
14
C je beta emiter, koji se ispušta u životnu sredinu uglavnom u okolini
nuklearnih postrojenja i tu su, u redovnom režimu rada, uglavnom prisutne niže
koncentracije aktivnosti izotopa
14
C [1]. Ova metoda može da nam bude od velike koristi
u slučaju nuklearnih akcidenata, jer zahvaljujući kratkom vremenu merenja i
jednostavnoj pripremi uzoraka vrlo brzo možemo doći do podataka o aktivnostima u
vodi i preduzeti neophodne mere zaštite od radijacije.
Optimizacijom metode pokazali smo za koji odnos voda:koktel ćemo dobiti
najveću efikasnost, koje vrednosti PAC parametra nam najbolje odgovaraju, kao i koji
nam je optimalni ROI. Da bismo ovom metodom mogli da vršimo monitoring okolnih
voda bitna nam je veličina MDA faktora, koji nam pokazuje koje koncentracije aktivnosti
možemo da merimo. Iz dobijenih podataka smo videli da čak i za kratko vreme merenja
od samo 30 minuta, za odgovarajuće odnose voda:koktel, dobijamo i dalje odlične
rezultate i da imamo niske vrednosti MDA faktora. Kako su dopuštene količine
aktivnosti radioizotopa
14
C u pijaćoj vodi do 240 Bq/l [19], zaključujemo da ovu metodu
možemo da koristimo i za merenje aktivnosti pijaćih voda.
Rezultati prezentovani u ovom radu mogu da služe kao vodič za razvoj,
optimizaciju i primenu metoda brze detekcije izotopa
14
C i u drugim laboratorijama.

36
https://www.radiocarbon.com/about-carbon-dating.htm
[13]Y. M. Tsipenyuk.
Nuclear Methods in Science and Technology.
Bristol, UK: Institute of
Physics Publishing, 1997. ISBN 0750304227
[14]M. J. Aitken.
Science-Based Dating in Archaeology.
Routledge, 1990. ISBN
9780582493094
[15]S. Bowman.
Radiocarbon dating
. London: British Museum Press, 1995. ISBN
0714120472
[16]Sources of radiocarbon.
https://c14.arch.ox.ac.uk/sources.html
[17]X. Hou.
Tritium and 14C in the Environment and Nuclear Facilities: Sources and
Analytical Methods.
Journal of Nuclear Fuel Cycle and Waste Technology, 2018.
https://doi.org/10.7733/jnfcwt.2018.16.1.11
[18]Liquid scintillation counting theory.
[19]Pravilnik o granicama sadržaja radionuklida u vodi za piće, životnim namirnicama,
stočnoj hrani, lekovima, premetima opšte upotrebe, građevinskom materijalu i
drugoj robi koja se stavlja u promet (“Službeni glasnik RS, br. 36 od 10.05.2018.)
https://www.srbatom.gov.rs/srbatomm/zakonska-regulativa/
[20]Water quality — Determination of carbon 14 activity — Liquid scintillation
counting method.
https://www.iso.org/standard/53403.html
37
Biografija
Sonja Vidović rođena je 13. avgusta 1995. godine u
Pančevu. Završila je osnovnu školu „Danilo Borković“ u
Gradišci i srednju školu „Gimnazija Gradiška“. Osnovne
akademske studije fizike, smer fizičar istraživač, je upisala
2014. godine na Prirodno-matematičkom fakultetu u Novom
Sadu.
Tokom studija učestvovala je na manifestacijama za
promociju nauke, kao što su „Noć istraživača“ i „Festival
nauke“, a bila je i učesnik letnje škole fizike „Fizika visokih
energija“ u Istraživačkoj stanici „Petnica“.
U toku studija je radila kao predavač fizike u
Novosadskom kulturno-obrazovnom krugu, gde je držala
individualne časove za sve uzraste, kao i pripremala učenike
za takmičenja u oblasti fizike, a držala je i grupne časove za polaganje male mature
učenicima osnovnih škola. U saradnji sa ostalim kolegama, autor je i priručnika za
polaganje male mature u izdanju Novosadskog kulturno-obrazovnog kruga.

39
Mesto i adresa:
Prirodno-matematički fakultet, Trg Dositeja Obradovića 4, Novi Sad
MA
Fizički opis rada:
3 poglavlja/37 strana/20 referenci/9 slika
FO
Naučna oblast:
Fizika
NO
Naučna disciplina:
Nuklearna fizika
ND
Predmetna odrednica/ključne reči:
14
C, monitoring, metoda, optimizacija, merenje, LSC
PO
UDK
Čuva se:
Biblioteka departmana za fiziku, PMF-a u Novom Sadu
ČU
Važna napomena:
nema
VN
Izvod:
Ovaj rad istražuje mogućnosti direktnog merenja koncentracije aktivnosti
14
C u
vodi, bez hemijske pripreme uzoraka, što bi obezbedilo prednosti kao što su
brzina, niska cena i jednostavnost analize radioaktivnih uzoraka, što je poželjno u
slučaju nuklearnih nesreća. Metod tečne scintilacione spektroskopije je
primenjen i optimizovan. Metod podrazumeva mešanje uzorka vode sa
scintilacionim koktelom (Permafluor E+). Merenja su vršena na niskofonskom
tečnom scintilacionom detektoru Wallac 1220 Quantulus. Optimizacija metoda je
uključivala optimalan odnos zapremina voda:koktel, optimalni merni prozor,
podešavanje PAC (komparator visine signala) parametra, na osnovu najviše
postignute vrednosti za FOM (faktor dobrote), kao i za efikasnost detekcije i
određivanje MDA (minimalne detektabilne aktivnosti).
IZ
Datum prihvaćanja teme od NN veća:
Mart, 2022.
DP
Datum odbrane: 0
5.04.2022.
DO
Članovi komisije:
KO
Predsednik:
dr Jovana Nikolov, vanredni profesor
član:
dr Ivana Stojković, vanredni profesor
član:
dr Nataša Todorović, redovni profesor, mentor
40
UNIVERSITY OF NOVI SAD
FACULTY OF SCIENCE
KEY WORDS DOCUMENTATION
Accession number:
ANO
Identification number:
INO
Document type:
Monograph publication
DT
Type of record:
Textual printed material
TR
Content code:
Final paper
CC
Author:
Sonja Vidović
AU
Mentor:
dr Nataša Todorović
MN
Title:
Optimisation of direct LSC method for
14
C measurement in water samples
TI
Language of text:
Serbian (latin)
LT
Language of abstract:
English
LA
Country of publication:
Republic of Serbia
CP
Locality of publication:
Autonomous Province of Vojvodina
LP
Publication year:
2022.
PY
Publisher:
Author’s reprint
PU
Publication place:
Faculty of Science, Trg Dositeja Obradovića 4, Novi Sad

Želiš da pročitaš svih 1 strana?
Prijavi se i preuzmi ceo dokument.
Slični dokumenti

Ovaj materijal je namenjen za učenje i pripremu, ne za predaju.


























































