Plemeniti gasovi: svojstva, jedinjenja i primena Pregled
PLEMENITI PLINOVI
(Atomska struktura, karakteristike i primjena u preksi)
1. UVOD
Plemeniti ili inertni plinovi su elementi nulte grupe Periodnog
sistema elemenata. Kako imaju popunjen poslednji energetski nivo,
gotovo uopšte ne reaguju. Helijum je element s najnižom tačkom
topljenja. I ostali plemeniti plinovi imaju veoma niske tačke ključanja i
topljenja u odnosu na atomsku masu. To je takođe posledica
popunjenosti elektronskog omotača. Između atoma plemenitih plinova
ne uspostavljaju se jače veze.
U ovu grupu elemenata spadaju: helijum (He), neon (Ne), argon
(Ar), kripton (Kr), ksenon (Xe) i radon (Rn).
1
PLEMENITI PLINOVI
(Atomska struktura, karakteristike i primjena u preksi)
2. Opšta svojstva elemenata u grupi
Zbog vrlo stabilne konfiguracije elementi ne mogu primiti nijedan
elektron, a da se ne počne popunjavati novi elektronski nivo. Popunjene
elektronske orbitale ne daju mogućnost međusobnog spajanja atoma
ovih elemenata, te su u sva tri agregatna stanja monoatomi. Plemeniti
plinovi imaju vrlo visoke vrednosti za energiju jonizacije tako da teško
mogu otpustiti elektron. Među atomima postoje samo Van Der Valsove
privlačne sile. One rastu sa porastom atomskog broja, a sa njima
temperatura topljenja i ključanja. Plemeniti plinovi nemaju miris i ukus, a
u vodi se slabo rastvaraju. Za helijum koji ima samo 2 elektrona vrednosti
topljenja i ključanja su najmanja. Helijum nije dobijen u čvrstom stanju.
Plemeniti plinovi ulaze u sastav atmosfere. Dobijaju se frakcionom
destilacijom tečnog vazduha.
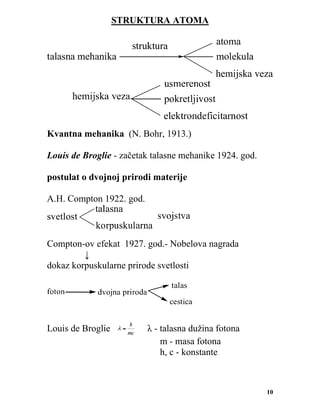
3. Plemeniti plinovi
Elementi O grupe nazivaju se još i plemenitim plinovma, dok su se
ranije nazivali inertnim plinovima jer se verovalo da se nulto valentni i da
ne grade jedinjenja. Otuda potiče naziv same grupe. Sada se u hemijskoj
literaturi ova grupa sve češće naziva VIIIa grupom. Ovi elementi su počeli
da se primenjuju tek 1910. kada je otkriveno da električna struja pri
prolasku kroz ove elemente daje obojenu svetlost. Do 1910. godine
plemeniti plinovi su imali samo teoretski značaj. Zajednička oznaka za
elektronsku konfiguraciju ove grupe je ns2 np6 (sa izuzetkom helijuma
čija je konfiguracija ns2 )sa popunjenim valentnim orbitalama.
2

PLEMENITI PLINOVI
(Atomska struktura, karakteristike i primjena u preksi)
Helijum u stanju plazme reaguje sa fluorom, folframom, živom,
sumporom, jodom, fosforom.
Kripton reaguje sa flurom na temperaturi bliskoj tački ključanja
azota.
Kr + F
2
-> KrF
2
Pri pritisku od 6 atmosfera ksenon reaguje sa fluorom.
Xe + F
2
-> XeF
2
Xe + 2F
2
-> XeF
4
Xe + 3F
2
-> XeF
6
Radon gradi RnF
2
i RnF
6
.
3.2. Helijum
Helijum je drugi po rasprostranjenosti element u vasioni, ali na
Zemlji se javlja samo u tragovima (4 × 10-7% u gornjim slojevima Zemlje).
Helijum se na Zemlji uglavnom javlja u atmosferi (5,2 × 10-4% u vazduhu).
U litosferi helijuma ima u veoma malim količinama. Praktično sav helijum
koji je postojao na Zemlji nije mogao da gradi jedinjenja sa drugim
elementima pa je zbog male mase napustio atmosferu Zemlje. Helijum
služi za ispitivanje materije pri vrlo niskim temperaturama. Pretpostavlja
se da je tečan i pri apsolutnoj nuli.
3.2.1. Izotopi i osobine
4
PLEMENITI PLINOVI
(Atomska struktura, karakteristike i primjena u preksi)
Javlja se u obliku 2 postojana izotopa — 3He i 4He kao i 4
nepostojana: 5He, 6He, 7He i 8He.
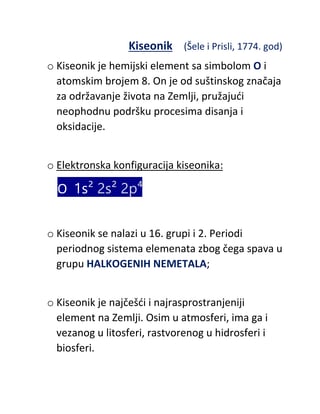
Helijum je plemeniti plin, najneaktivniji hemijski element, sa veoma
velikom energijom jonizacije. Nema nikakav biološki značaj.
3.2.2. Upotreba
Helijum se u tečnom obliku koristi za hlađenje tamo gde su
potrebne veoma niske temperature, zbog njegove niske tačke ključanja.
Tečni helijum koristi se za magnetne rezonance.
Kao najlakši siguran plin (nezapaljiv) koristio se za punjenje balona.
Sada se sve ređe koristi zbog velikih troškova pri dobijanju, a umesto
njega se najčešće koristi zagrejan vazduh.
Zbog male rastvorljivosti u krvi koristi se kao sastojak mešavine za
ronjenje na velikim dubinama.
5
Želiš da pročitaš svih 17 strana?
Prijavi se i preuzmi ceo dokument.
Slični dokumenti

Ovaj materijal je namenjen za učenje i pripremu, ne za predaju.